Номер 4, страница 198 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 5. Химическая связь. Параграф 47. Кристаллическое состояние вещества - номер 4, страница 198.
№4 (с. 198)
Условие. №4 (с. 198)
скриншот условия

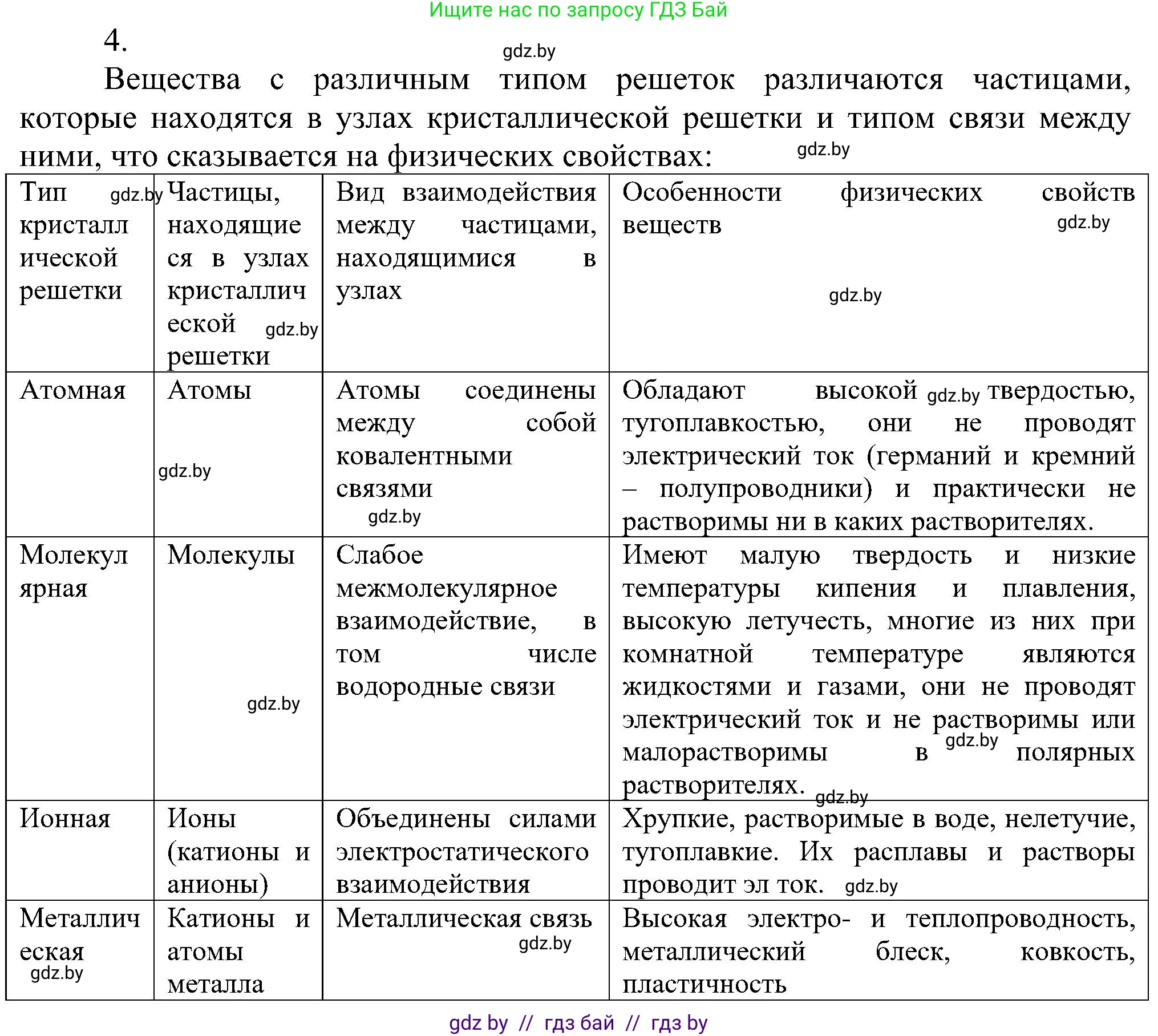
4. В чем состоит различие ионных, атомных и металлических решеток? Как это сказывается на различии в свойствах веществ с соответствующим типом решетки?
Решение. №4 (с. 198)
Решение 2. №4 (с. 198)
Различие между ионными, атомными и металлическими кристаллическими решетками заключается в типе частиц, расположенных в узлах решетки, и характере химической связи между ними. Эти различия напрямую определяют физические и химические свойства веществ.
Ионные решетки
В узлах ионных кристаллических решеток находятся положительно и отрицательно заряженные ионы (катионы и анионы), которые удерживаются вместе силами электростатического притяжения. Такой тип связи называется ионной. Примерами веществ с ионной решеткой являются соли (например, хлорид натрия $NaCl$), щелочи (например, гидроксид натрия $NaOH$) и оксиды активных металлов (например, оксид магния $MgO$).
Свойства, обусловленные строением:
Высокие температуры плавления и кипения. Ионные связи очень прочные, и для их разрушения требуется большое количество энергии.
Твердость и хрупкость. Вещества твердые, так как ионы сильно связаны друг с другом. Однако при механическом воздействии (ударе) происходит сдвиг слоев решетки. Одноименно заряженные ионы оказываются друг против друга, силы отталкивания приводят к разрушению кристалла.
Электропроводность. В твердом состоянии ионные кристаллы не проводят электрический ток, так как ионы жестко зафиксированы в узлах решетки. Однако в расплавах или водных растворах они диссоциируют на подвижные ионы и становятся хорошими проводниками (электролитами).
Растворимость. Многие вещества с ионной решеткой хорошо растворимы в полярных растворителях, таких как вода.
Ответ: В узлах ионных решеток находятся катионы и анионы, связанные сильной ионной связью. Это обуславливает их тугоплавкость, твердость, хрупкость и способность проводить ток только в расплавленном или растворенном состоянии.
Атомные решетки
В узлах атомных решеток расположены нейтральные атомы, соединенные друг с другом очень прочными ковалентными связями. Вся решетка представляет собой одну гигантскую макромолекулу. Вещества с таким типом решетки немногочисленны, но широко известны: алмаз и графит (аллотропные модификации углерода $C$), кремний ($Si$), бор ($B$), диоксид кремния (кварц, $SiO_2$).
Свойства, обусловленные строением:
Очень высокие температуры плавления и кипения. Для плавления такого вещества необходимо разорвать прочнейшие ковалентные связи, что требует колоссальных затрат энергии.
Исключительная твердость. Направленные и прочные ковалентные связи делают эти вещества самыми твердыми из всех известных (например, алмаз — эталон твердости).
Нерастворимость. Практически не растворяются ни в одном из известных растворителей.
Электропроводность. В большинстве случаев являются диэлектриками, так как в них отсутствуют свободные носители заряда — все электроны участвуют в образовании ковалентных связей. Исключением является графит, имеющий слоистую структуру и обладающий электропроводностью за счет делокализованных электронов внутри слоев.
Ответ: В узлах атомных решеток находятся атомы, связанные прочными ковалентными связями в единый каркас. Это придает веществам высочайшую твердость, тугоплавкость, нерастворимость и, как правило, отсутствие электропроводности.
Металлические решетки
Структура металлической решетки представляет собой упорядоченное расположение положительных ионов металлов (атом-ионов), которые находятся в "море" из обобществленных валентных электронов. Эти электроны свободно перемещаются по всему объему кристалла и не принадлежат конкретному атому. Эта система удерживается вместе за счет электростатического притяжения между положительными ионами и отрицательным "электронным газом". Такой тип решетки характерен для всех металлов и их сплавов (например, железо $Fe$, медь $Cu$, алюминий $Al$).
Свойства, обусловленные строением:
Высокая электро- и теплопроводность. Наличие свободных, подвижных электронов обеспечивает эффективный перенос заряда (электрический ток) и тепловой энергии.
Пластичность (ковкость и тягучесть). При механическом воздействии слои ионов могут смещаться друг относительно друга без разрыва связей, так как "электронный газ" действует как связующая "смазка", мгновенно перераспределяясь и сохраняя целостность кристалла.
Металлический блеск. Свободные электроны на поверхности металла взаимодействуют со светом, поглощая и тут же переизлучая фотоны, что и создает характерный блеск.
Широкий диапазон температур плавления и твердости. Эти свойства зависят от прочности металлической связи, которая определяется числом валентных электронов, зарядом и радиусом иона.
Ответ: В узлах металлической решетки находятся катионы, погруженные в "море" свободных электронов. Наличие "электронного газа" определяет ключевые свойства металлов: высокую электро- и теплопроводность, пластичность и характерный блеск.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 4 расположенного на странице 198 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 198), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













