Номер 9, страница 18, часть 2 - гдз по химии 7 класс тетрадь для практических работ Борушко
Авторы: Борушко И. И.
Тип: Тетрадь для практических работ
Издательство: Сэр-Вит
Год издания: 2022 - 2025
Часть: 2
Цвет обложки: розовый с колбами
ISBN: 978-985-597-590-9
Рекомендовано Научно-методическим учреждением «Национальный институт образования» Министерства образования Республики Беларусь
Популярные ГДЗ в 7 классе
Часть 2. Лабораторные опыты. Лабораторные опыты. Cамоподготовка к практическим работам. Практическая работа 4 - номер 9, страница 18.
№9 (с. 18)
Условие. №9 (с. 18)
скриншот условия

9. Внимательно изучите содержание практической работы по тексту учебника. Продумайте последовательность операций при получении кислорода и исследовании его свойств. Составьте начальный вариант отчета по предложенному вам образцу.
Решение. №9 (с. 18)
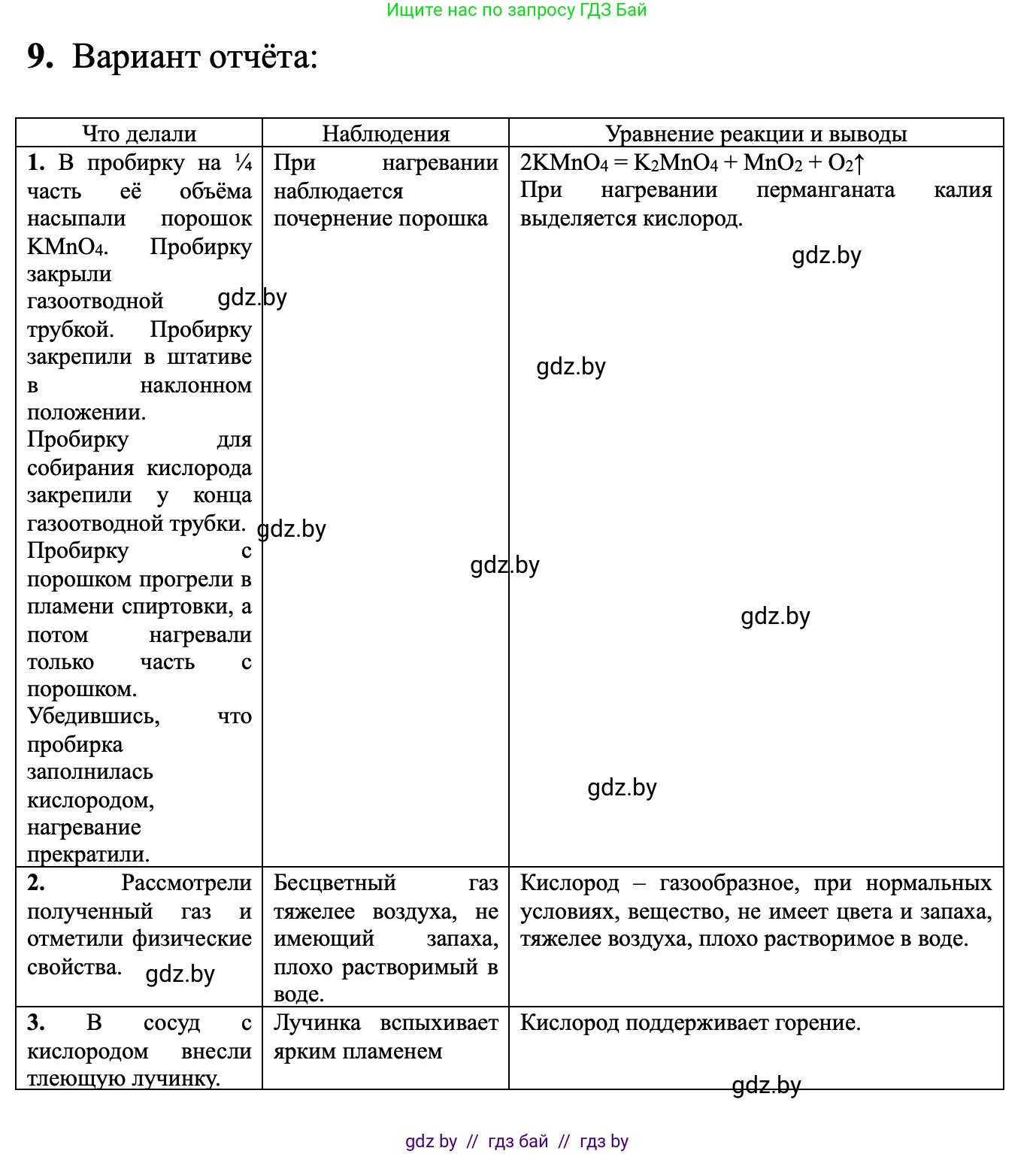
Решение 2. №9 (с. 18)
Продумайте последовательность операций при получении кислорода и исследовании его свойств
Для получения кислорода в лабораторных условиях часто используют термическое разложение перманганата калия ($KMnO_4$). Последовательность операций включает:
1. Подготовка оборудования:
Сборка прибора для получения газов: штатив с пробиркой, закрепленной под небольшим углом, газоотводная трубка, опущенная в сосуд для сбора газа (например, цилиндр, наполненный водой, для сбора методом вытеснения воды, или пустой цилиндр для сбора методом вытеснения воздуха). Проверка прибора на герметичность: конец газоотводной трубки опускают в воду, а пробирку слегка нагревают. Если появляются пузырьки воздуха, прибор герметичен. После остывания вода не должна подниматься по трубке.
2. Получение кислорода:
Внесение реагента: в чистую сухую пробирку помещают небольшое количество порошка перманганата калия ($KMnO_4$). Нагревание: пробирку с перманганатом калия осторожно нагревают пламенем спиртовки, начиная с равномерного прогрева всей пробирки, затем концентрируя пламя на месте нахождения реагента. Важно следить, чтобы газоотводная трубка не засорялась. Уравнение реакции: $2KMnO_4 \xrightarrow{t} K_2MnO_4 + MnO_2 + O_2\uparrow$.
3. Сбор кислорода:
Методом вытеснения воды: сосуд (например, пробирку или цилиндр) наполняют водой, переворачивают вверх дном и опускают в кристаллизатор с водой. Конец газоотводной трубки помещают под отверстие сосуда. Кислород, как малорастворимый в воде газ, вытесняет воду из сосуда. Методом вытеснения воздуха: если кислород собирают методом вытеснения воздуха (поскольку он немного плотнее воздуха), сосуд-приемник держат открытым концом вверх, а газоотводную трубку опускают до дна. Однако, метод вытеснения воды предпочтительнее для получения чистого газа.
4. Исследование свойств кислорода:
Определение физических свойств: кислород - газ без цвета, запаха и вкуса, малорастворим в воде, немного тяжелее воздуха. Подтверждение наличия кислорода (химический тест): в собранный кислород вносят тлеющую лучинку (деревянная палочка с тлеющим концом). В атмосфере кислорода лучинка ярко вспыхивает, что является качественной реакцией на кислород. Изучение химических свойств (примеры): Горение серы в кислороде: в ложечку для сжигания помещают кусочек серы, поджигают ее в пламени спиртовки (сера горит синим пламенем), затем опускают в сосуд с кислородом. Сера продолжает гореть ярким синим пламенем. Уравнение реакции: $S + O_2 \xrightarrow{t} SO_2\uparrow$. Горение уголька (углерода) в кислороде: аналогично сере, уголек поджигают и опускают в кислород. Он ярко вспыхивает. Уравнение реакции: $C + O_2 \xrightarrow{t} CO_2\uparrow$. Горение железной проволоки в кислороде: на конце железной проволоки закрепляют тлеющую лучинку (для поджигания), проволоку нагревают и опускают в сосуд с кислородом. Железо ярко горит, разбрасывая искры. Уравнение реакции: $3Fe + 2O_2 \xrightarrow{t} Fe_3O_4$.
5. Завершение работы:
По окончании опыта газоотводную трубку сначала вынимают из воды (или сосуда-приемника), а затем прекращают нагревание. Это предотвращает засасывание воды в горячую пробирку, что может привести к ее растрескиванию.
Составьте начальный вариант отчета по предложенному вам образцу
Начальный вариант отчета по практической работе может включать следующие разделы:
Название работы: Получение кислорода и изучение его свойств.
Цель работы: Ознакомиться с лабораторным способом получения кислорода, изучить его физические и химические свойства.
Оборудование и реактивы: Штатив, пробирка, газоотводная трубка, спиртовка, кристаллизатор, химические стаканы (или цилиндры) для сбора газа, ложечка для сжигания, тлеющая лучинка, спички. Перманганат калия ($KMnO_4$), сера ($S$), уголь ($C$), железная проволока ($Fe$), вода.
Ход работы: (Здесь подробно описывается последовательность действий, аналогично разделу "Последовательность операций...", с указанием наблюдений для каждого шага) 1. Сборка прибора для получения газа (схема). 2. Загрузка перманганата калия в пробирку, закрепление ее в штативе. 3. Нагревание пробирки и сбор кислорода методом вытеснения воды. 4. Определение физических свойств кислорода (цвет, запах, растворимость). 5. Проведение качественной реакции на кислород (тлеющая лучинка). 6. Изучение химических свойств кислорода: горение серы, горение угля, горение железной проволоки. 7. Завершение работы.
Наблюдения: (В этом разделе фиксируются все увиденные изменения, например) При нагревании перманганата калия образуется газ. Газ собирается в сосуде, вытесняя воду, он бесцветен и без запаха. Тлеющая лучинка, внесенная в сосуд с газом, ярко вспыхивает. Сера горит ярким синим пламенем, уголь - ярким свечением, железная проволока - с яркими искрами и образованием черного продукта.
Уравнения реакций: (Здесь приводятся химические уравнения всех проведенных реакций) Получение кислорода: $2KMnO_4 \xrightarrow{t} K_2MnO_4 + MnO_2 + O_2\uparrow$. Горение серы: $S + O_2 \xrightarrow{t} SO_2\uparrow$. Горение угля: $C + O_2 \xrightarrow{t} CO_2\uparrow$. Горение железа: $3Fe + 2O_2 \xrightarrow{t} Fe_3O_4$.
Вывод: В ходе практической работы был получен кислород термическим разложением перманганата калия. Подтверждено, что кислород - бесцветный газ без запаха, поддерживающий горение. Изучены химические свойства кислорода на примере реакций горения серы, угля и железа.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 7 класс, для упражнения номер 9 расположенного на странице 18 для 2-й части к тетради для практических работ 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №9 (с. 18), автора: Борушко (Ирина Ивановна), 2-й части учебного пособия издательства Сэр-Вит.













