Номер 3, страница 6 - гдз по химии 8 класс сборник контрольных и самостоятельных работ Сеген, Власовец

Авторы: Сеген Е. А., Власовец Е. Н., Гарбар Е. Е., Синявская Т. С.
Тип: Сборник контрольных и самостоятельных работ
Издательство: Аверсэв
Год издания: 2019 - 2025
Цвет обложки: оранжевый с колбой
ISBN: 978-985-19-4532-6
Рекомендовано Научно-методическим учреждением "Национальный институт образования" Министерства образования Республики Беларусь
Популярные ГДЗ в 8 классе
Контрольная работа 1. По теме «Повторение основных вопросов курса химии 7 класса. Количественные понятия в химии». Вариант 3. Вариант 3 - номер 3, страница 6.
№3 (с. 6)
Решение. №3 (с. 6)
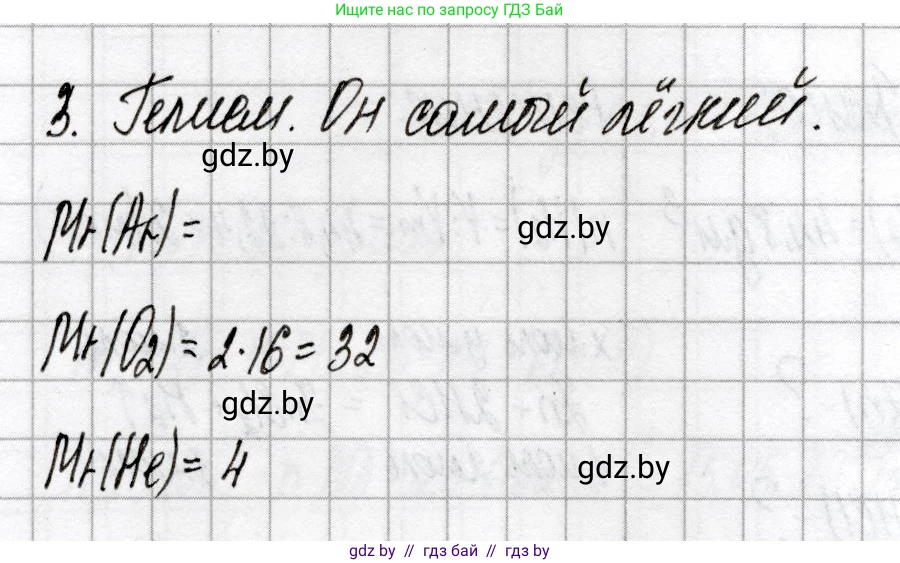
Решение 2. №3 (с. 6)
Дано
Газы для рассмотрения: аргон (Ar), кислород (O₂), гелий (He).
Перевод в СИ: (Для данной сравнительной задачи, где требуется определить относительную плотность газов, перевод всех данных в систему СИ не является строго необходимым. Молярные массы будут использоваться для сравнения плотностей, и их значения в г/моль достаточны для получения правильного ответа.)
Найти:
Какой из перечисленных газов следует использовать для заполнения шара для воздухоплавания.
Решение
Принцип воздухоплавания основан на законе Архимеда: для того чтобы объект мог подниматься в воздухе, его средняя плотность должна быть меньше плотности окружающего воздуха. В случае воздушного шара это означает, что газ, которым наполнен шар, должен быть легче окружающего воздуха.
Плотность газа ($ \rho $) при одинаковых температуре ($ T $) и давлении ($ P $) прямо пропорциональна его молярной массе ($ M $). Это следует из уравнения состояния идеального газа: $ P \cdot V = n \cdot R \cdot T $, где $ V $ - объем, $ n $ - количество молей, $ R $ - универсальная газовая постоянная. Так как $ n = \frac{m}{M} $, где $ m $ - масса газа, и $ \rho = \frac{m}{V} $, мы можем получить: $ P \cdot V = \frac{m}{M} \cdot R \cdot T $ $ P = \frac{m}{V} \cdot \frac{R \cdot T}{M} $ $ P = \rho \cdot \frac{R \cdot T}{M} $ Отсюда: $ \rho = \frac{P \cdot M}{R \cdot T} $
Поскольку температура и давление для сравнения остаются одинаковыми, плотность газа напрямую зависит от его молярной массы. Чем меньше молярная масса газа, тем меньше его плотность.
Рассмотрим среднюю молярную массу воздуха и молярные массы предложенных газов:
Молярная масса воздуха (смесь примерно 78% азота, 21% кислорода, 1% аргона и других газов): $ M_{воздуха} \approx 29 \text{ г/моль} $.
Молярная масса аргона (Ar): $ M_{Ar} \approx 39.95 \text{ г/моль} $.
Молярная масса кислорода (O₂): $ M_{O_2} \approx 32.00 \text{ г/моль} $.
Молярная масса гелия (He): $ M_{He} \approx 4.00 \text{ г/моль} $.
Сравним молярные массы газов с молярной массой воздуха:
1. Аргон ($ M_{Ar} \approx 39.95 \text{ г/моль} $): Молярная масса аргона больше молярной массы воздуха ($ 39.95 > 29 $). Следовательно, аргон плотнее воздуха, и шар, заполненный аргоном, не будет подниматься.
2. Кислород ($ M_{O_2} \approx 32.00 \text{ г/моль} $): Молярная масса кислорода также больше молярной массы воздуха ($ 32.00 > 29 $). Кислород плотнее воздуха, и шар, заполненный кислородом, не будет подниматься.
3. Гелий ($ M_{He} \approx 4.00 \text{ г/моль} $): Молярная масса гелия значительно меньше молярной массы воздуха ($ 4.00 < 29 $). Гелий гораздо легче воздуха, что создает необходимую подъемную силу для воздухоплавания.
Исходя из сравнения молярных масс, гелий является единственным из предложенных газов, который значительно легче воздуха и, следовательно, подходит для воздухоплавания.
Ответ: Шар для воздухоплавания следует заполнить гелием.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 3 расположенного на странице 6 к сборнику контрольных и самостоятельных работ 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 6), авторов: Сеген (Елена Адамовна), Власовец (Евгения Николаевна), Гарбар (Елена Евгеньевна), Синявская (Тамара Степановна), учебного пособия издательства Аверсэв.













