Номер 3, страница 16 - гдз по химии 8 класс сборник контрольных и самостоятельных работ Сеген, Власовец

Авторы: Сеген Е. А., Власовец Е. Н., Гарбар Е. Е., Синявская Т. С.
Тип: Сборник контрольных и самостоятельных работ
Издательство: Аверсэв
Год издания: 2019 - 2025
Цвет обложки: оранжевый с колбой
ISBN: 978-985-19-4532-6
Рекомендовано Научно-методическим учреждением "Национальный институт образования" Министерства образования Республики Беларусь
Популярные ГДЗ в 8 классе
Контрольная работа 4. По теме «Химическая связь», «Растворы». Вариант 1. Вариант 1 - номер 3, страница 16.
№3 (с. 16)
Решение. №3 (с. 16)
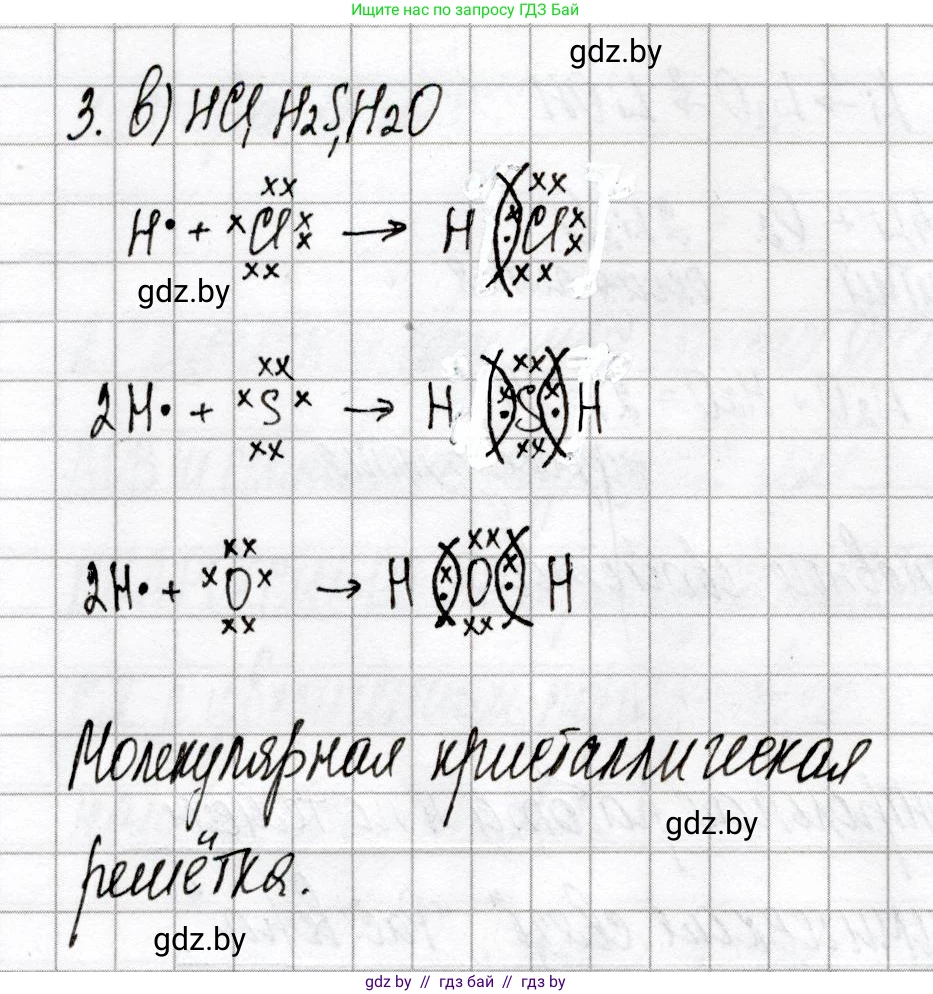
Решение 2. №3 (с. 16)
Решение
Выбор ряда
Необходимо выбрать ряд, в котором все вещества имеют только ковалентные полярные связи. Проанализируем каждый из предложенных рядов:
а) CuSO₄ (сульфат меди(II)) и NaCl (хлорид натрия) являются ионными соединениями. В них присутствуют ионные связи между катионами и анионами (например, Cu²⁺ и SO₄²⁻, Na⁺ и Cl⁻), хотя внутри сложного иона SO₄²⁻ есть ковалентные полярные связи. Таким образом, этот ряд не подходит, так как содержит ионные связи.
б) NaOH (гидроксид натрия) является ионным соединением (Na⁺ и OH⁻). Хотя внутри иона OH⁻ связь O-H ковалентная полярная, само соединение имеет ионную связь. Этот ряд не подходит.
в) HCl (хлороводород), H₂S (сероводород) и H₂O (вода) — все эти вещества состоят из молекул, образованных только ковалентными полярными связями. Во всех случаях связь образуется между атомами водорода и более электроотрицательными неметаллами (Cl, S, O), что приводит к смещению электронной плотности и образованию полярной ковалентной связи.
г) NaNO₃ (нитрат натрия) и NaCl (хлорид натрия) являются ионными соединениями. Этот ряд не подходит.
Таким образом, единственным рядом, где все вещества имеют исключительно ковалентные полярные связи, является ряд в) HCl, H₂S, H₂O.
Ответ: Ряд в) HCl, H₂S, H₂O
Схемы образования этих соединений
Ковалентная полярная связь образуется между атомами с различной электроотрицательностью путем образования общих электронных пар, которые смещаются в сторону более электроотрицательного атома.
1. Хлороводород (HCl)
Атом водорода (H) имеет 1 валентный электрон. Атом хлора (Cl) имеет 7 валентных электронов. Для образования стабильной электронной конфигурации (дуплет для H, октет для Cl) эти атомы образуют одну общую электронную пару.
Схема образования: $H + Cl \rightarrow H-Cl$ (химическая связь образуется путем обобществления электронов).
Поскольку электроотрицательность хлора (по Полингу 3.16) выше, чем у водорода (2.20), общая электронная пара смещена к атому хлора, что придает ему частичный отрицательный заряд ($\delta^-$), а атому водорода — частичный положительный заряд ($\delta^+$).
2. Сероводород (H₂S)
Атом серы (S) имеет 6 валентных электронов. Каждый из двух атомов водорода (H) имеет 1 валентный электрон. Атом серы образует две ковалентные связи, обобществляя по одному электрону с каждым атомом водорода.
Схема образования: $H + S + H \rightarrow H-S-H$ (сернистый водород имеет угловую структуру, в которой две связи H-S являются полярными).
Электроотрицательность серы (2.58) выше, чем у водорода (2.20), поэтому электронные пары в связях H-S смещены к атому серы.
3. Вода (H₂O)
Атом кислорода (O) имеет 6 валентных электронов. Каждый из двух атомов водорода (H) имеет 1 валентный электрон. Атом кислорода образует две ковалентные связи, обобществляя по одному электрону с каждым атомом водорода.
Схема образования: $H + O + H \rightarrow H-O-H$ (молекула воды также имеет угловую структуру).
Электроотрицательность кислорода (3.44) значительно выше, чем у водорода (2.20), что приводит к сильному смещению электронных пар к атому кислорода и высокой полярности связей H-O.
Ответ: Схемы образования связей описаны выше.
Тип кристаллической структуры, характерной для них
Все соединения (HCl, H₂S, H₂O), в которых связи являются ковалентными полярными и которые образуют дискретные молекулы, в твердом состоянии формируют молекулярную кристаллическую решетку. В узлах такой решетки расположены отдельные молекулы, связанные между собой относительно слабыми межмолекулярными силами (например, диполь-дипольными взаимодействиями и водородными связями в случае воды).
Ответ: Молекулярная кристаллическая решетка.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 3 расположенного на странице 16 к сборнику контрольных и самостоятельных работ 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 16), авторов: Сеген (Елена Адамовна), Власовец (Евгения Николаевна), Гарбар (Елена Евгеньевна), Синявская (Тамара Степановна), учебного пособия издательства Аверсэв.













