Номер 5, страница 73 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 2. Важнейшие классы неорганических соединений. Параграф 17. Химические свойства кислот. Изменение окраски индикаторов. Взаимодействие с металлами - номер 5, страница 73.
№5 (с. 73)
Условие. №5 (с. 73)
скриншот условия

5. Рассчитайте массу серной кислоты, которая в водном растворе прореагирует с железом массой 11,2 г.
Решение. №5 (с. 73)
Решение 2. №5 (с. 73)
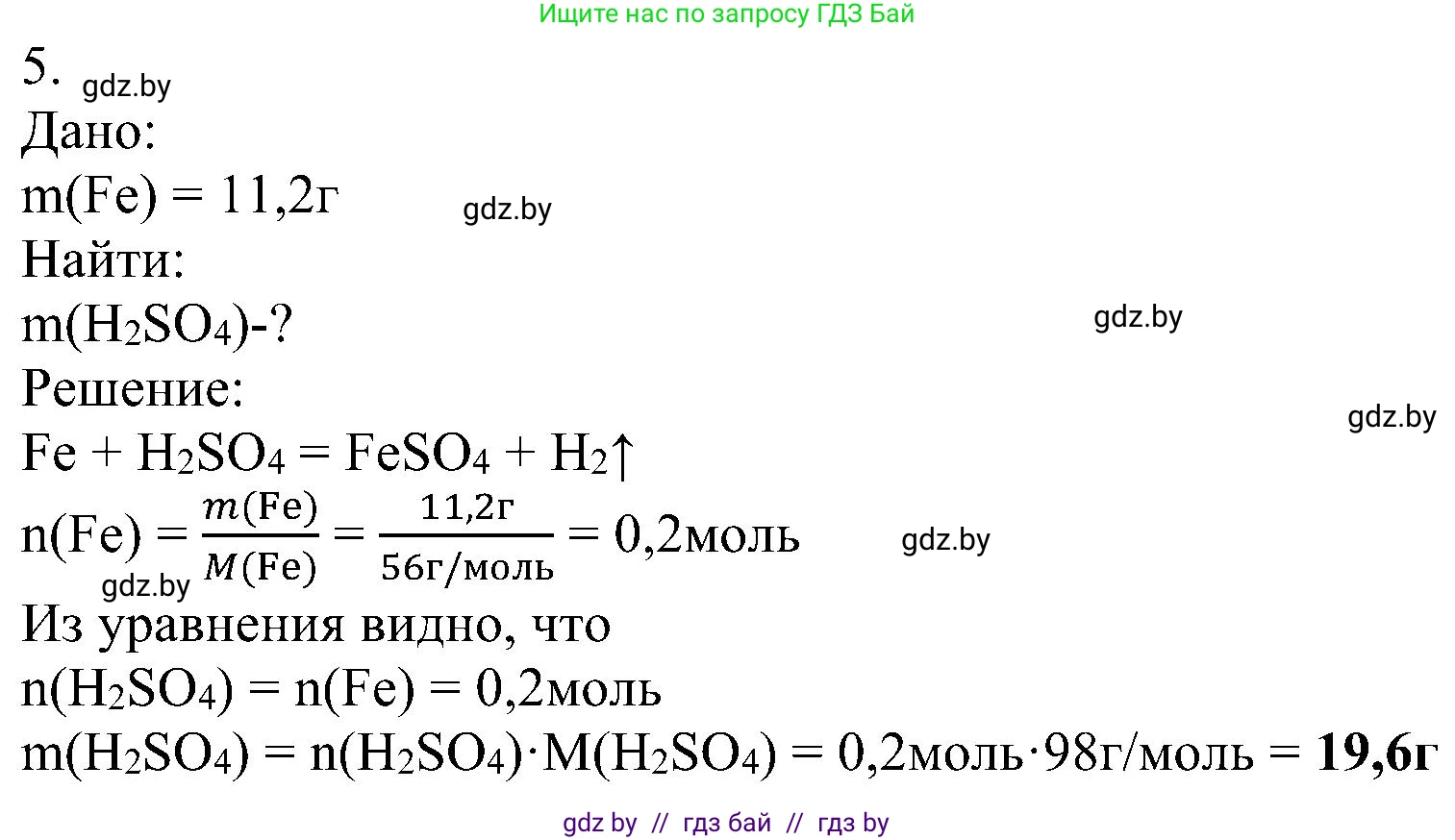
Дано:
$m(Fe) = 11,2$ г
Найти:
$m(H_{2}SO_{4}) - ?$
Решение:
1. Составим уравнение химической реакции взаимодействия железа с водным раствором серной кислоты. Поскольку железо стоит в ряду активности металлов до водорода, оно будет вытеснять водород из кислоты с образованием соли и газообразного водорода:
$Fe + H_{2}SO_{4} \rightarrow FeSO_{4} + H_{2}\uparrow$
Уравнение сбалансировано, стехиометрические коэффициенты перед реагентами равны 1. Это означает, что на 1 моль железа расходуется 1 моль серной кислоты.
2. Рассчитаем количество вещества (число моль) железа, масса которого дана в условии, по формуле $n = \frac{m}{M}$, где $m$ — масса, а $M$ — молярная масса.
Молярная масса железа, согласно периодической таблице, составляет $M(Fe) \approx 56$ г/моль.
$n(Fe) = \frac{m(Fe)}{M(Fe)} = \frac{11,2 \text{ г}}{56 \text{ г/моль}} = 0,2$ моль.
3. По уравнению реакции, количество вещества серной кислоты, вступившей в реакцию, равно количеству вещества железа:
$\frac{n(Fe)}{1} = \frac{n(H_{2}SO_{4})}{1}$
$n(H_{2}SO_{4}) = n(Fe) = 0,2$ моль.
4. Теперь, зная количество вещества серной кислоты, можем найти ее массу по формуле $m = n \cdot M$.
Сначала вычислим молярную массу серной кислоты ($H_{2}SO_{4}$):
$M(H_{2}SO_{4}) = 2 \cdot Ar(H) + Ar(S) + 4 \cdot Ar(O) = 2 \cdot 1 + 32 + 4 \cdot 16 = 98$ г/моль.
Рассчитаем массу серной кислоты:
$m(H_{2}SO_{4}) = n(H_{2}SO_{4}) \cdot M(H_{2}SO_{4}) = 0,2 \text{ моль} \cdot 98 \text{ г/моль} = 19,6$ г.
Ответ: масса серной кислоты, которая прореагирует с 11,2 г железа, равна 19,6 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 5 расположенного на странице 73 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 73), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













