Номер 3, страница 153 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 4. Строение атома и периодичность изменения свойств атомов химических элементов и их соединений. Параграф 36. Состояние электронов в атоме. Электронное облако. Атомная орбиталь - номер 3, страница 153.
№3 (с. 153)
Условие. №3 (с. 153)
скриншот условия
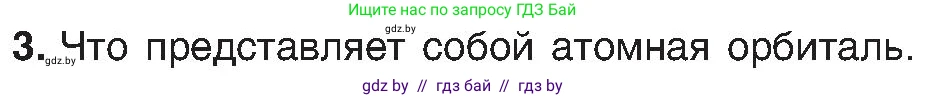
3. Что представляет собой атомная орбиталь.
Решение. №3 (с. 153)

Решение 2. №3 (с. 153)
Атомная орбиталь — это фундаментальное понятие в квантовой механике и химии, которое описывает волновое поведение электрона в атоме. В отличие от устаревшей планетарной модели Бора, где электроны движутся по строго определенным круговым орбитам, современная квантовая модель рассматривает электрон как объект, обладающий свойствами и частицы, и волны. Его положение и импульс невозможно определить одновременно и точно в каждый момент времени (согласно принципу неопределенности Гейзенберга).
Вместо этого, атомная орбиталь представляет собой математическую функцию, называемую волновой функцией ($\Psi$), которая является решением уравнения Шрёдингера для данного атома. Эта функция несет в себе всю информацию о состоянии электрона.
Физический смысл имеет квадрат модуля волновой функции ($|\Psi|^2$). Эта величина определяет плотность вероятности — вероятность нахождения электрона в определенной точке пространства вокруг ядра. Таким образом, атомную орбиталь часто визуализируют как область пространства (электронное облако), в которой заключена значительная часть (например, 90% или 95%) этой вероятности.
Характеристики и типы орбиталейКаждая атомная орбиталь в атоме однозначно описывается набором из трех квантовых чисел:
- Главное квантовое число (n): Определяет энергетический уровень электрона и общий размер орбитали. Принимает целочисленные значения: $n = 1, 2, 3, \ldots$. Чем больше $n$, тем выше энергия электрона и тем дальше от ядра находится область его наиболее вероятного пребывания.
- Орбитальное (азимутальное) квантовое число (l): Определяет форму атомной орбитали. Для заданного $n$ оно может принимать значения от $0$ до $n-1$. Орбитали с разными значениями $l$ имеют буквенные обозначения:
- $l=0$ — s-орбиталь (сферическая форма).
- $l=1$ — p-орбиталь (форма объемной восьмерки или гантели).
- $l=2$ — d-орбиталь (более сложная форма, часто в виде четырехлепестковой розетки).
- $l=3$ — f-орбиталь (еще более сложная форма).
- Магнитное квантовое число (m_l): Определяет ориентацию орбитали в пространстве. Для заданного $l$ оно может принимать целочисленные значения от $-l$ до $+l$, включая $0$. Количество возможных значений $m_l$ ($2l+1$) показывает, сколько орбиталей данной формы существует на энергетическом подуровне. Например:
- Для s-орбитали ($l=0$): одно значение $m_l=0$, то есть одна s-орбиталь на каждом уровне.
- Для p-орбиталей ($l=1$): три значения $m_l = -1, 0, +1$, что соответствует трем p-орбиталям ($p_x, p_y, p_z$), ориентированным взаимно перпендикулярно.
- Для d-орбиталей ($l=2$): пять значений $m_l = -2, -1, 0, +1, +2$, то есть пять d-орбиталей с разной пространственной ориентацией.
Важно отметить, что согласно принципу Паули, на одной орбитали может находиться не более двух электронов, причем они должны иметь противоположные спины (спин описывается четвертым, спиновым квантовым числом $m_s$, которое к характеристике самой орбитали не относится).
Ответ: Атомная орбиталь — это область пространства вокруг атомного ядра, в которой наиболее вероятно (с вероятностью >90%) нахождение данного электрона. Математически она описывается волновой функцией ($\Psi$), которая является решением уравнения Шрёдингера и характеризуется набором трех квантовых чисел (главного, орбитального и магнитного), определяющих энергию, форму и пространственную ориентацию орбитали.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 3 расположенного на странице 153 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 153), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













