Готовимся к олимпиадам, страница 102 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 2. Важнейшие классы неорганических соединений. Параграф 24. Химические свойства солей - страница 102.
Готовимся к олимпиадам (с. 102)
Условие. Готовимся к олимпиадам (с. 102)
скриншот условия

Готовимся к олимпиадам
1. Порцию медного купороса растворили в воде. К приготовленному раствору добавили раствор гидроксида калия, взятый в избытке, в результате чего образовался осадок массой 36 г. Рассчитайте массу исходного медного купороса.
Решение. Готовимся к олимпиадам (с. 102)
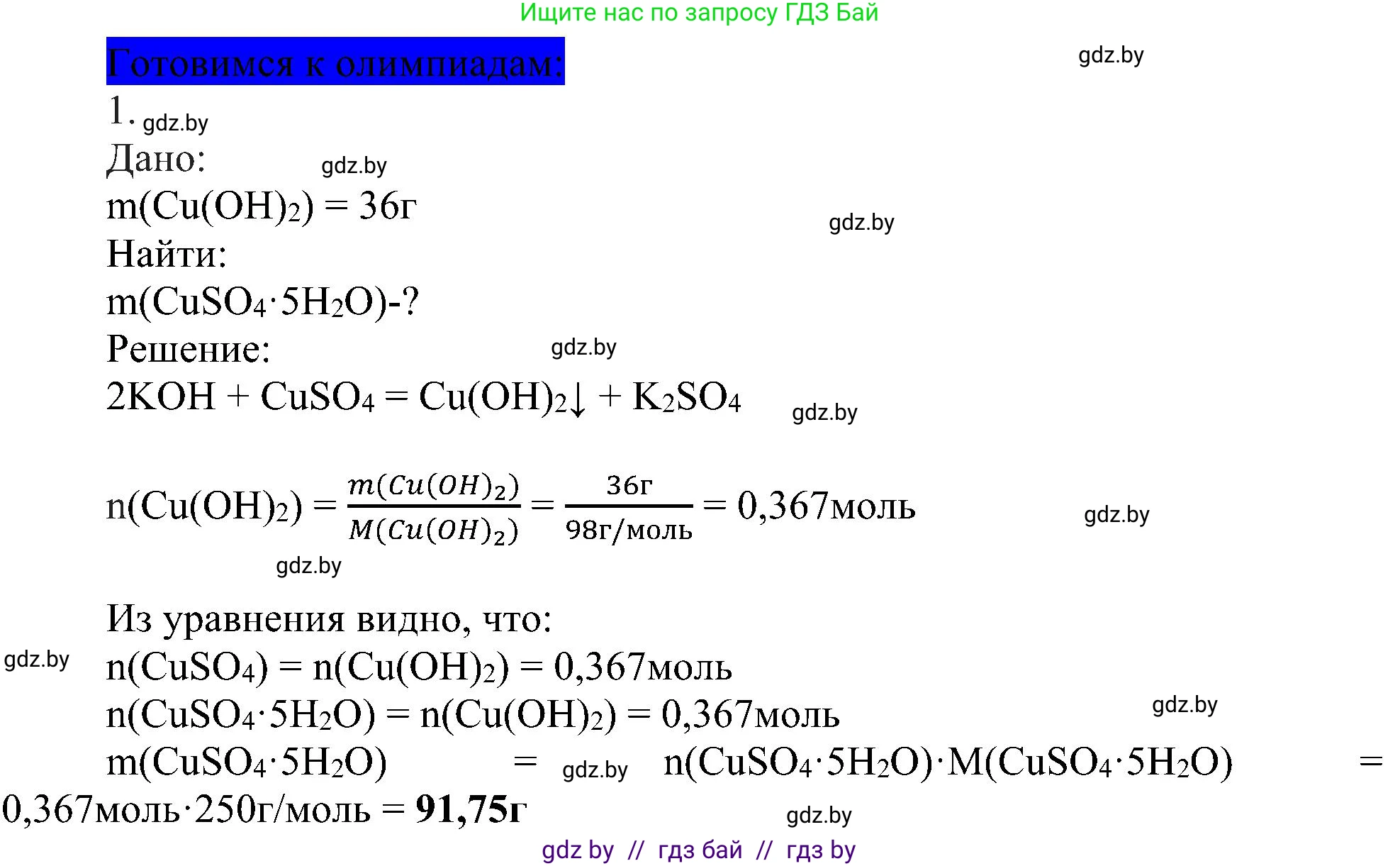
Решение 2. Готовимся к олимпиадам (с. 102)
1.
Дано:
Масса осадка $m(Cu(OH)_2) = 36$ г
Гидроксид калия взят в избытке.
Перевод данных в систему СИ:
Масса осадка $m(Cu(OH)_2) = 36 \text{ г} = 0.036 \text{ кг}$
Найти:
Массу исходного медного купороса $m(CuSO_4 \cdot 5H_2O)$
Решение:
Медный купорос – это тривиальное название кристаллогидрата сульфата меди(II), химическая формула которого $CuSO_4 \cdot 5H_2O$.
При растворении медного купороса в воде образуется раствор сульфата меди(II). При добавлении к этому раствору гидроксида калия ($KOH$) происходит реакция обмена, в результате которой выпадает осадок гидроксида меди(II) ($Cu(OH)_2$).
Запишем уравнение химической реакции:
$CuSO_4 + 2KOH \rightarrow Cu(OH)_2 \downarrow + K_2SO_4$
По условию задачи, гидроксид калия был взят в избытке. Это означает, что весь сульфат меди, полученный из медного купороса, полностью прореагировал с образованием осадка $Cu(OH)_2$.
Для решения задачи нам понадобятся молярные массы гидроксида меди(II) и медного купороса. Рассчитаем их, используя относительные атомные массы элементов из Периодической таблицы (Ar(Cu) ≈ 63.5, Ar(S) ≈ 32, Ar(O) ≈ 16, Ar(H) ≈ 1).
Молярная масса гидроксида меди(II) ($Cu(OH)_2$):
$M(Cu(OH)_2) = Ar(Cu) + 2 \times (Ar(O) + Ar(H)) = 63.5 + 2 \times (16 + 1) = 63.5 + 34 = 97.5$ г/моль.
Молярная масса медного купороса ($CuSO_4 \cdot 5H_2O$):
$M(CuSO_4 \cdot 5H_2O) = (Ar(Cu) + Ar(S) + 4 \times Ar(O)) + 5 \times (2 \times Ar(H) + Ar(O)) = (63.5 + 32 + 4 \times 16) + 5 \times (2 \times 1 + 16) = 159.5 + 5 \times 18 = 159.5 + 90 = 249.5$ г/моль.
Теперь найдем количество вещества (число моль) выпавшего осадка $Cu(OH)_2$ массой 36 г:
$n(Cu(OH)_2) = \frac{m(Cu(OH)_2)}{M(Cu(OH)_2)} = \frac{36 \text{ г}}{97.5 \text{ г/моль}} \approx 0.3692$ моль.
Согласно уравнению реакции, 1 моль $CuSO_4$ образует 1 моль $Cu(OH)_2$. Следовательно, их количества вещества соотносятся как 1:1. В свою очередь, 1 моль медного купороса $CuSO_4 \cdot 5H_2O$ содержит 1 моль ионов меди, из которых и образуется $CuSO_4$ в растворе. Таким образом, количество вещества исходного медного купороса равно количеству вещества выпавшего осадка:
$n(CuSO_4 \cdot 5H_2O) = n(CuSO_4) = n(Cu(OH)_2) \approx 0.3692$ моль.
Наконец, рассчитаем массу исходной порции медного купороса:
$m(CuSO_4 \cdot 5H_2O) = n(CuSO_4 \cdot 5H_2O) \times M(CuSO_4 \cdot 5H_2O)$
$m(CuSO_4 \cdot 5H_2O) \approx 0.3692 \text{ моль} \times 249.5 \text{ г/моль} \approx 92.12$ г.
Для большей точности можно провести расчет без промежуточных округлений:
$m(CuSO_4 \cdot 5H_2O) = \frac{36}{97.5} \times 249.5 = 92.123...$ г.
Округляя результат до сотых, получаем 92.12 г.
Ответ: масса исходного медного купороса составляет 92.12 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения Готовимся к олимпиадам расположенного на странице 102 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Готовимся к олимпиадам (с. 102), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













