Готовимся к олимпиадам, страница 220 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 6. Окислительно-восстановительные реакции. Параграф 52. Окислительно-восстановительные реакции вокруг нас - страница 220.
Готовимся к олимпиадам (с. 220)
Условие. Готовимся к олимпиадам (с. 220)
скриншот условия
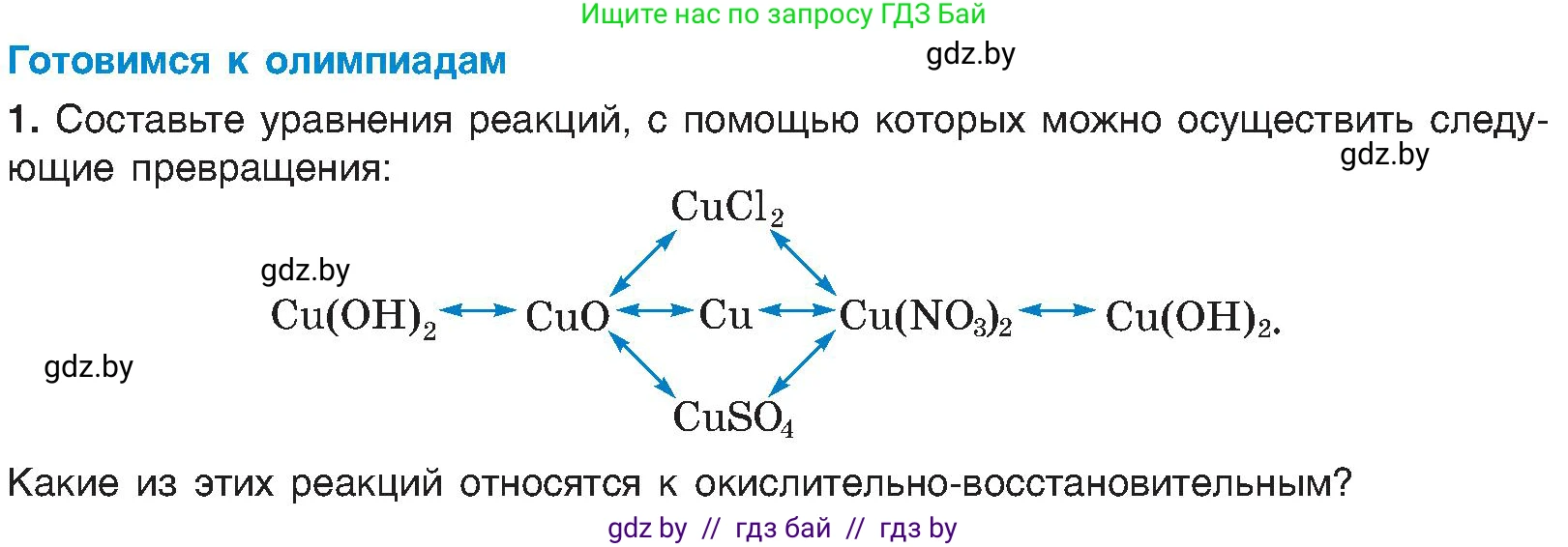
Готовимся к олимпиадам
1. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
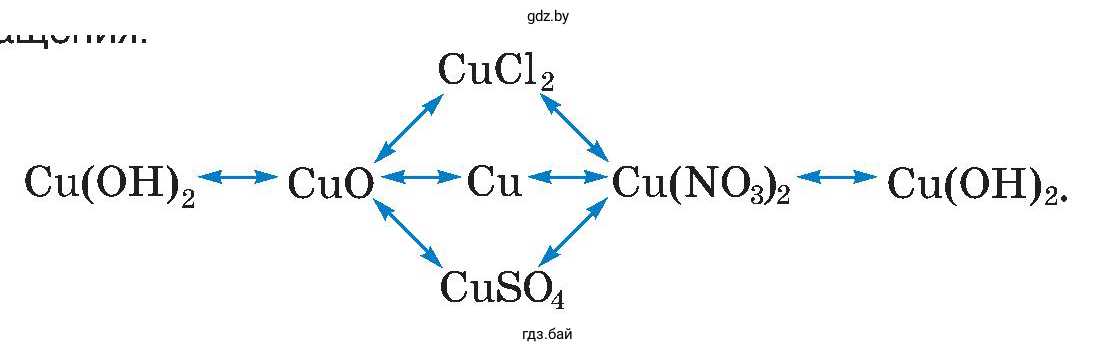
Какие из этих реакций относятся к окислительно-восстановительным?
Решение. Готовимся к олимпиадам (с. 220)

Решение 2. Готовимся к олимпиадам (с. 220)
Cu(OH)₂ → CuO
Термическое разложение гидроксида меди(II) при нагревании с образованием оксида меди(II) и воды. Это реакция разложения.
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
Ответ: $Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
CuO → Cu(OH)₂
Оксид меди(II) является основным оксидом, нерастворимым в воде, поэтому прямая реакция гидратации не идет. Получение гидроксида меди(II) из оксида меди(II) проводят в две стадии: сначала оксид переводят в растворимую соль действием кислоты, а затем на соль действуют щелочью.
1. $CuO + 2HNO_3 \rightarrow Cu(NO_3)_2 + H_2O$
2. $Cu(NO_3)_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaNO_3$
Ответ: $CuO + 2HNO_3 \rightarrow Cu(NO_3)_2 + H_2O$; $Cu(NO_3)_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaNO_3$
CuO → Cu
Восстановление оксида меди(II) до металлической меди. В качестве восстановителя можно использовать водород, угарный газ, углерод или аммиак. Приведем пример с водородом.
$CuO + H_2 \xrightarrow{t} Cu + H_2O$
Ответ: $CuO + H_2 \xrightarrow{t} Cu + H_2O$
Cu → CuO
Окисление меди кислородом воздуха при нагревании. Это реакция соединения.
$2Cu + O_2 \xrightarrow{t} 2CuO$
Ответ: $2Cu + O_2 \xrightarrow{t} 2CuO$
CuO → CuCl₂
Реакция основного оксида с кислотой (соляной кислотой) с образованием соли и воды. Это реакция обмена.
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
Ответ: $CuO + 2HCl \rightarrow CuCl_2 + H_2O$
CuO → Cu(NO₃)₂
Реакция основного оксида с кислотой (азотной кислотой) с образованием соли и воды. Это реакция обмена.
$CuO + 2HNO_3 \rightarrow Cu(NO_3)_2 + H_2O$
Ответ: $CuO + 2HNO_3 \rightarrow Cu(NO_3)_2 + H_2O$
CuO → CuSO₄
Реакция основного оксида с кислотой (серной кислотой) с образованием соли и воды. Это реакция обмена.
$CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
Ответ: $CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
CuCl₂ → Cu
Восстановление меди из раствора ее соли более активным металлом, например, железом. Это реакция замещения.
$CuCl_2 + Fe \rightarrow FeCl_2 + Cu$
Ответ: $CuCl_2 + Fe \rightarrow FeCl_2 + Cu$
Cu(NO₃)₂ → Cu
Восстановление меди из раствора ее соли более активным металлом, например, цинком. Это реакция замещения.
$Cu(NO_3)_2 + Zn \rightarrow Zn(NO_3)_2 + Cu$
Ответ: $Cu(NO_3)_2 + Zn \rightarrow Zn(NO_3)_2 + Cu$
CuSO₄ → Cu
Восстановление меди из раствора ее соли более активным металлом, например, железом. Это реакция замещения, лежащая в основе процесса цементации меди.
$CuSO_4 + Fe \rightarrow FeSO_4 + Cu$
Ответ: $CuSO_4 + Fe \rightarrow FeSO_4 + Cu$
Cu(NO₃)₂ → Cu(OH)₂
Реакция обмена между растворимой солью меди(II) и щелочью, в результате которой выпадает осадок гидроксида меди(II) голубого цвета.
$Cu(NO_3)_2 + 2KOH \rightarrow Cu(OH)_2\downarrow + 2KNO_3$
Ответ: $Cu(NO_3)_2 + 2KOH \rightarrow Cu(OH)_2\downarrow + 2KNO_3$
Cu(OH)₂ → Cu(NO₃)₂
Реакция нейтрализации нерастворимого основания кислотой с образованием соли и воды.
$Cu(OH)_2 + 2HNO_3 \rightarrow Cu(NO_3)_2 + 2H_2O$
Ответ: $Cu(OH)_2 + 2HNO_3 \rightarrow Cu(NO_3)_2 + 2H_2O$
Какие из этих реакций относятся к окислительно-восстановительным?
Окислительно-восстановительными (ОВР) называются реакции, в ходе которых происходит изменение степеней окисления атомов, входящих в состав реагирующих веществ. В данной схеме к ОВР относятся все реакции, в которых простое вещество медь (степень окисления 0) превращается в соединение (где медь имеет степень окисления +2) или наоборот, ион меди(II) восстанавливается до металлической меди.
Такими реакциями являются:
$CuO \rightarrow Cu$ (степень окисления меди меняется с +2 на 0)
$Cu \rightarrow CuO$ (степень окисления меди меняется с 0 на +2)
$CuCl_2 \rightarrow Cu$ (степень окисления меди меняется с +2 на 0)
$Cu(NO_3)_2 \rightarrow Cu$ (степень окисления меди меняется с +2 на 0)
$CuSO_4 \rightarrow Cu$ (степень окисления меди меняется с +2 на 0)
Ответ: К окислительно-восстановительным относятся реакции: $CuO \rightarrow Cu$, $Cu \rightarrow CuO$, $CuCl_2 \rightarrow Cu$, $Cu(NO_3)_2 \rightarrow Cu$, $CuSO_4 \rightarrow Cu$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения Готовимся к олимпиадам расположенного на странице 220 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Готовимся к олимпиадам (с. 220), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













