Номер 7, страница 214 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 6. Окислительно-восстановительные реакции. Параграф 51. Представление о методе электронного баланса - номер 7, страница 214.
№7 (с. 214)
Условие. №7 (с. 214)
скриншот условия

7. Укажите сумму всех коэффициентов в уравнении окислительно-восстановительной реакции, протекающей по схеме:
$ \text{Mg} + \text{H}_2\text{SO}_{4(\text{конц}.)} \rightarrow \text{MgSO}_4 + \text{H}_2\text{S} + \text{H}_2\text{O} $
Решение. №7 (с. 214)
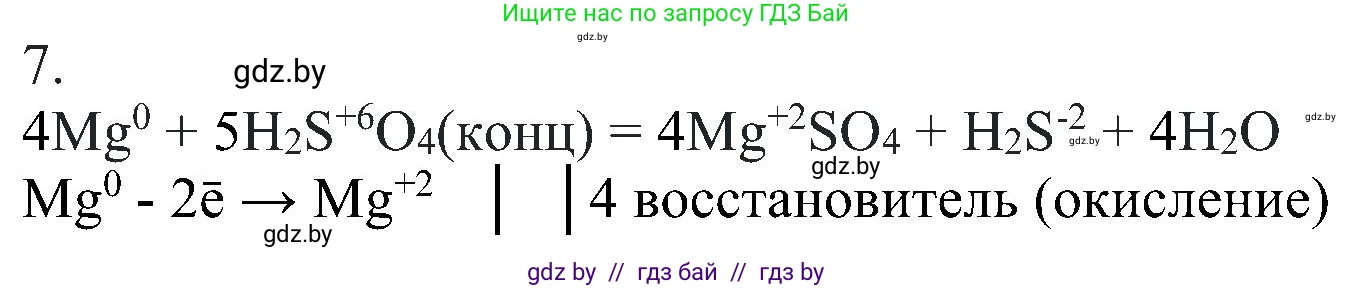

Решение 2. №7 (с. 214)
Решение
Для того чтобы найти сумму коэффициентов в уравнении реакции, необходимо сначала правильно расставить коэффициенты. Данная реакция является окислительно-восстановительной, поэтому для расстановки коэффициентов воспользуемся методом электронного баланса.
1. Запишем схему реакции и определим степени окисления элементов, которые их изменяют в ходе реакции:
$ \overset{0}{\text{Mg}} + \text{H}_2\overset{+6}{\text{S}}\text{O}_4(\text{конц.}) \rightarrow \overset{+2}{\text{Mg}}\overset{+6}{\text{S}}\text{O}_4 + \text{H}_2\overset{-2}{\text{S}} + \text{H}_2\text{O} $
Из схемы видно, что изменяются степени окисления у магния и серы:
- Магний (Mg) повышает свою степень окисления с 0 до +2. Это процесс окисления, Mg является восстановителем.
- Сера (S) понижает свою степень окисления с +6 (в H₂SO₄) до -2 (в H₂S). Это процесс восстановления, H₂SO₄ является окислителем.
2. Составим полуреакции окисления и восстановления:
Окисление: $ \overset{0}{\text{Mg}} - 2e^- \rightarrow \overset{+2}{\text{Mg}} $
Восстановление: $ \overset{+6}{\text{S}} + 8e^- \rightarrow \overset{-2}{\text{S}} $
3. Найдём наименьшее общее кратное (НОК) для числа отданных (2) и принятых (8) электронов. НОК(2, 8) = 8. Это означает, что в реакции участвует 8 электронов. Чтобы сбалансировать число электронов, домножим первую полуреакцию на 4, а вторую — на 1.
$ \overset{0}{\text{Mg}} - 2e^- \rightarrow \overset{+2}{\text{Mg}} \quad|\quad \times 4 $ (восстановитель, окисляется)
$ \overset{+6}{\text{S}} + 8e^- \rightarrow \overset{-2}{\text{S}} \quad|\quad \times 1 $ (окислитель, восстанавливается)
4. Полученные множители являются коэффициентами в уравнении реакции. Ставим коэффициент 4 перед Mg и MgSO₄, и коэффициент 1 (который обычно не пишется) перед H₂S.
$ 4\text{Mg} + \text{H}_2\text{SO}_4 \rightarrow 4\text{MgSO}_4 + 1\text{H}_2\text{S} + \text{H}_2\text{O} $
5. Теперь уравняем остальные атомы. Сначала уравняем серу. В правой части уравнения 4 атома серы в $4\text{MgSO}_4$ и 1 атом серы в $\text{H}_2\text{S}$, что в сумме дает 5 атомов серы. Следовательно, в левой части перед $\text{H}_2\text{SO}_4$ нужно поставить коэффициент 5.
$ 4\text{Mg} + 5\text{H}_2\text{SO}_4 \rightarrow 4\text{MgSO}_4 + \text{H}_2\text{S} + \text{H}_2\text{O} $
6. Далее уравниваем водород. В левой части в $5\text{H}_2\text{SO}_4$ содержится $5 \times 2 = 10$ атомов водорода. В правой части 2 атома водорода находятся в $\text{H}_2\text{S}$. Чтобы уравнять водород, необходимо, чтобы в молекулах воды было $10 - 2 = 8$ атомов водорода. Для этого ставим коэффициент 4 перед $\text{H}_2\text{O}$ ($4 \times 2 = 8$).
$ 4\text{Mg} + 5\text{H}_2\text{SO}_4 \rightarrow 4\text{MgSO}_4 + \text{H}_2\text{S} + 4\text{H}_2\text{O} $
7. В последнюю очередь проверяем баланс по кислороду. В левой части: $5 \times 4 = 20$ атомов кислорода. В правой части: $(4 \times 4) + (4 \times 1) = 16 + 4 = 20$ атомов кислорода. Баланс соблюден. Уравнение составлено верно.
8. Итоговое сбалансированное уравнение реакции:
$ 4\text{Mg} + 5\text{H}_2\text{SO}_4 = 4\text{MgSO}_4 + \text{H}_2\text{S} + 4\text{H}_2\text{O} $
9. Вычислим сумму всех коэффициентов в уравнении (учитывая коэффициент 1 перед $\text{H}_2\text{S}$):
Сумма коэффициентов = $4 + 5 + 4 + 1 + 4 = 18$
Ответ: 18
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7 расположенного на странице 214 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 214), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













