Номер 249, страница 51 - гдз по химии 8 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: голубой, зелёный с кристаллами
ISBN: 978-985-599-064-3
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава І. Важнейшие классы неорганических соединений. Параграф 18. Получение и применение оснований - номер 249, страница 51.
№249 (с. 51)
Условие. №249 (с. 51)
скриншот условия

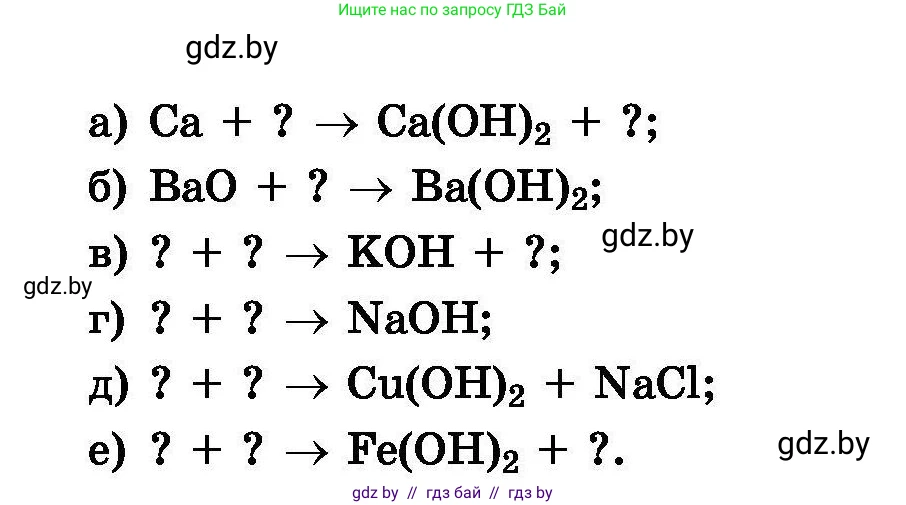
249. Замените знак вопроса на формулы соответствующих веществ и расставьте коэффициенты в следующих схемах химических реакций:
а) $Ca + ? \to Ca(OH)_2 + ?$;
б) $BaO + ? \to Ba(OH)_2$;
в) $? + ? \to KOH + ?$;
г) $? + ? \to NaOH$;
д) $? + ? \to Cu(OH)_2 + NaCl$;
е) $? + ? \to Fe(OH)_2 + ?$.
Решение. №249 (с. 51)
Решение 2. №249 (с. 51)
а)В данной схеме показана реакция активного металла (кальция) с неизвестным веществом с образованием гидроксида кальция $Ca(OH)_2$ и еще одного продукта. Активные металлы реагируют с водой с образованием гидроксида и выделением водорода. Следовательно, неизвестные вещества — это вода ($H_2O$) и водород ($H_2$).
Схема реакции: $Ca + H_2O \rightarrow Ca(OH)_2 + H_2$.
Для уравнивания числа атомов кислорода и водорода необходимо поставить коэффициент 2 перед молекулой воды в левой части уравнения.
Слева: 1 атом Ca, 4 атома H, 2 атома O.
Справа: 1 атом Ca, 4 атома H (2 в $Ca(OH)_2$ и 2 в $H_2$), 2 атома O.
Количество атомов всех элементов в левой и правой частях равно.
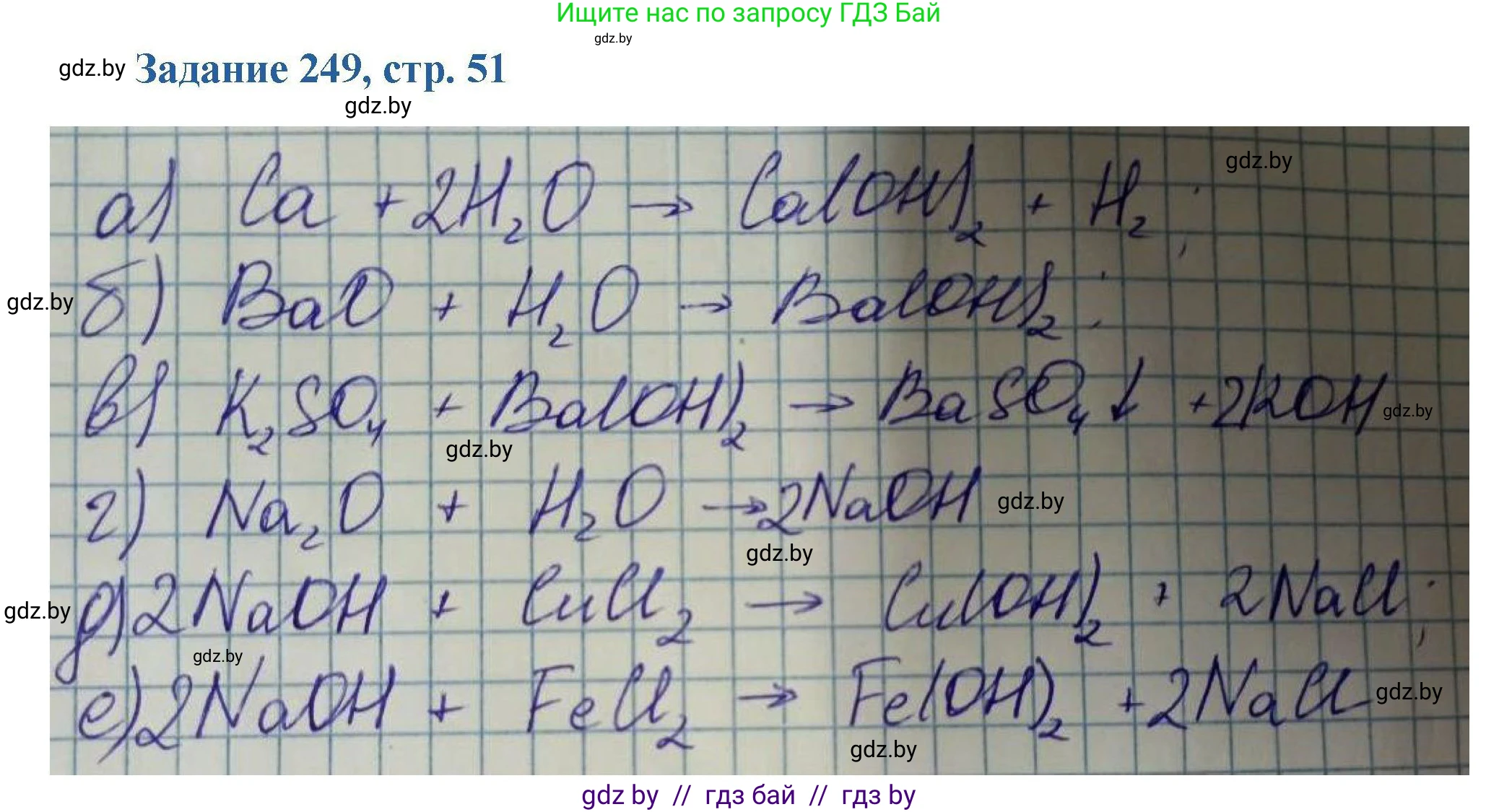
Ответ: $Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2$
б)В реакции участвует оксид бария ($BaO$), который является основным оксидом, и в результате образуется гидроксид бария ($Ba(OH)_2$), являющийся основанием (щелочью). Основные оксиды реагируют с водой с образованием соответствующих гидроксидов. Значит, неизвестное вещество — это вода ($H_2O$).
Схема реакции: $BaO + H_2O \rightarrow Ba(OH)_2$.
Проверим баланс атомов.
Слева: 1 атом Ba, 2 атома O (1 в $BaO$ и 1 в $H_2O$), 2 атома H.
Справа: 1 атом Ba, 2 атома O, 2 атома H.
Уравнение сбалансировано, дополнительные коэффициенты не требуются.
Ответ: $BaO + H_2O \rightarrow Ba(OH)_2$
в)В результате реакции образуется гидроксид калия ($KOH$), который является щелочью, и еще один продукт. Один из способов получения щелочей — взаимодействие щелочных металлов с водой. В этом случае реагентами будут калий ($K$) и вода ($H_2O$), а вторым продуктом — водород ($H_2$).
Схема реакции: $K + H_2O \rightarrow KOH + H_2$.
Уравняем реакцию методом подбора коэффициентов. Поставим коэффициент 2 перед $KOH$, чтобы уравнять нечетное количество атомов водорода справа. Затем уравняем калий, поставив коэффициент 2 перед $K$ слева. Наконец, уравняем кислород и водород, поставив коэффициент 2 перед $H_2O$.
Проверка:
Слева: 2 атома K, 4 атома H, 2 атома O.
Справа: 2 атома K, 4 атома H (2 в $KOH$ и 2 в $H_2$), 2 атома O.
Уравнение сбалансировано.
Ответ: $2K + 2H_2O \rightarrow 2KOH + H_2$
г)В данной схеме из двух реагентов образуется один продукт — гидроксид натрия ($NaOH$). Это реакция соединения. Гидроксид натрия (щелочь) можно получить реакцией соответствующего основного оксида — оксида натрия ($Na_2O$) — с водой ($H_2O$).
Схема реакции: $Na_2O + H_2O \rightarrow NaOH$.
Для уравнивания числа атомов натрия, кислорода и водорода поставим коэффициент 2 перед $NaOH$.
Слева: 2 атома Na, 2 атома O, 2 атома H.
Справа: 2 атома Na, 2 атома O, 2 атома H.
Уравнение сбалансировано.
Ответ: $Na_2O + H_2O \rightarrow 2NaOH$
д)Продуктами реакции являются нерастворимое основание гидроксид меди(II) ($Cu(OH)_2$) и растворимая соль хлорид натрия ($NaCl$). Это качественная реакция ионного обмена, которая протекает между растворимой солью и щелочью. Чтобы в продуктах были ионы $Cu^{2+}$, $OH^-$, $Na^+$ и $Cl^-$, исходные вещества должны содержать эти ионы. В качестве соли возьмем хлорид меди(II) ($CuCl_2$), а в качестве щелочи — гидроксид натрия ($NaOH$).
Схема реакции: $CuCl_2 + NaOH \rightarrow Cu(OH)_2 + NaCl$.
Для баланса нужно 2 гидроксид-иона ($OH^-$), значит, ставим коэффициент 2 перед $NaOH$. Это приводит к 2 ионам натрия слева, поэтому ставим коэффициент 2 перед $NaCl$ справа, чтобы уравнять ионы натрия и хлора.
Проверка:
Слева: 1 атом Cu, 2 атома Cl, 2 атома Na, 2 атома O, 2 атома H.
Справа: 1 атом Cu, 2 атома O, 2 атома H, 2 атома Na, 2 атома Cl.
Уравнение сбалансировано.
Ответ: $CuCl_2 + 2NaOH \rightarrow Cu(OH)_2 + 2NaCl$
е)В результате реакции образуется нерастворимый гидроксид железа(II) ($Fe(OH)_2$) и еще один продукт. По аналогии с предыдущим примером, это реакция ионного обмена между растворимой солью железа(II) и щелочью. Выберем в качестве реагентов хлорид железа(II) ($FeCl_2$) и гидроксид калия ($KOH$). Вторым продуктом реакции будет хлорид калия ($KCl$).
Схема реакции: $FeCl_2 + KOH \rightarrow Fe(OH)_2 + KCl$.
Чтобы уравнять реакцию, поставим коэффициент 2 перед $KOH$ для баланса гидроксид-ионов и коэффициент 2 перед $KCl$ для баланса ионов калия и хлора.
Проверка:
Слева: 1 атом Fe, 2 атома Cl, 2 атома K, 2 атома O, 2 атома H.
Справа: 1 атом Fe, 2 атома O, 2 атома H, 2 атома K, 2 атома Cl.
Уравнение сбалансировано. (Примечание: возможны и другие варианты, например, $FeSO_4 + 2NaOH \rightarrow Fe(OH)_2 + Na_2SO_4$).
Ответ: $FeCl_2 + 2KOH \rightarrow Fe(OH)_2 + 2KCl$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 249 расположенного на странице 51 к сборнику задач 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №249 (с. 51), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.













