Номер 631, страница 109 - гдз по химии 8 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: голубой, зелёный с кристаллами
ISBN: 978-985-599-064-3
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава V. Окислительно-восстановительные реакции. Параграф 43. Процессы окисления и восстановления - номер 631, страница 109.
№631 (с. 109)
Условие. №631 (с. 109)
скриншот условия

631. Могут ли атомы одного и того же элемента в одних реакциях проявлять окислительные свойства, а в других — восстановительные? Если могут, то приведите три примера таких реакций.
Решение. №631 (с. 109)
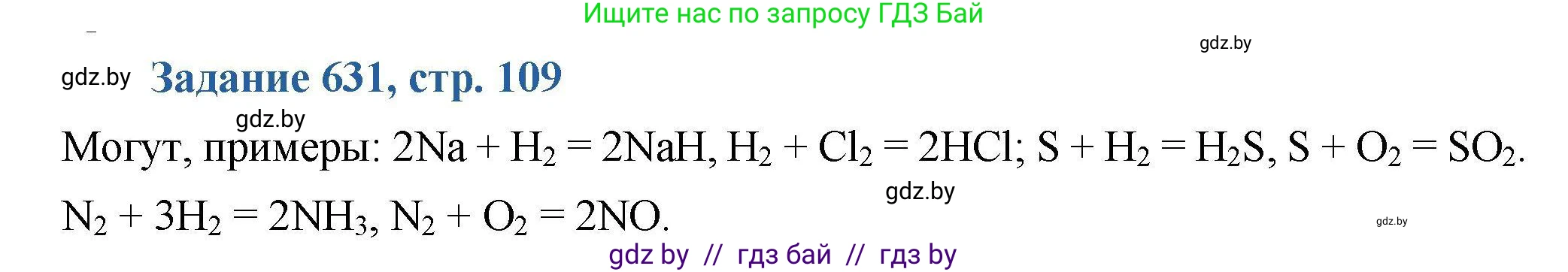
Решение 2. №631 (с. 109)
Да, атомы одного и того же элемента могут в одних реакциях проявлять окислительные свойства, а в других — восстановительные. Это явление называется окислительно-восстановительной двойственностью.
Оно характерно для элементов, которые находятся в промежуточной степени окисления. Такой атом может как принимать электроны, понижая свою степень окисления (выступая в роли окислителя), так и отдавать электроны, повышая свою степень окисления (выступая в роли восстановителя). Конкретное поведение элемента зависит от того, с каким веществом (более сильным окислителем или более сильным восстановителем) он реагирует.
РешениеПриведем три примера, иллюстрирующих это свойство.
1. Сера (S) в степени окисления 0.
Сера имеет возможные степени окисления от -2 до +6. Степень окисления 0 является промежуточной.
В реакции с восстановителями (например, с металлами или водородом) сера выступает как окислитель, принимая электроны и понижая степень окисления до -2:
$\stackrel{0}{H_2} + \stackrel{0}{S} \rightarrow \stackrel{+1}{H_2}\stackrel{-2}{S}$
Здесь сера восстанавливается (является окислителем).
В реакции с более сильными окислителями, например, с кислородом или фтором, сера выступает как восстановитель, отдавая электроны и повышая свою степень окисления:
$\stackrel{0}{S} + \stackrel{0}{O_2} \rightarrow \stackrel{+4}{S}\stackrel{-2}{O_2}$
Здесь сера окисляется (является восстановителем).
Ответ: Элементарная сера (S) может быть и окислителем (например, в реакции с водородом), и восстановителем (например, в реакции с кислородом).
2. Азот (N) в степени окисления +3 (в азотистой кислоте HNO₂).
Азот имеет возможные степени окисления от -3 до +5. Степень окисления +3 является промежуточной.
При взаимодействии с более сильными восстановителями, например, с иодоводородом (HI), азотистая кислота проявляет окислительные свойства:
$2H\stackrel{+3}{N}O_2 + 2H\stackrel{-1}{I} \rightarrow \stackrel{0}{I_2} + 2\stackrel{+2}{N}O \uparrow + 2H_2O$
Азот принимает электроны, его степень окисления понижается с +3 до +2 (является окислителем).
При взаимодействии с более сильными окислителями, например, с перманганатом калия (KMnO₄) в кислой среде, азотистая кислота проявляет восстановительные свойства:
$5H\stackrel{+3}{N}O_2 + 2K\stackrel{+7}{Mn}O_4 + 3H_2SO_4 \rightarrow 5H\stackrel{+5}{N}O_3 + 2\stackrel{+2}{Mn}SO_4 + K_2SO_4 + 3H_2O$
Азот отдает электроны, его степень окисления повышается с +3 до +5 (является восстановителем).
Ответ: Азот в степени окисления +3 (например, в составе азотистой кислоты) может быть и окислителем (в реакции с HI), и восстановителем (в реакции с KMnO₄).
3. Хлор (Cl) в степени окисления 0 (в простом веществе Cl₂).
Хлор имеет возможные степени окисления от -1 до +7. Степень окисления 0 является промежуточной. Окислительно-восстановительная двойственность хлора может проявиться в одной и той же реакции — реакции диспропорционирования.
При взаимодействии хлора с горячим раствором щелочи он одновременно выступает и окислителем, и восстановителем:
$3\stackrel{0}{Cl_2} + 6KOH \rightarrow 5K\stackrel{-1}{Cl} + K\stackrel{+5}{Cl}O_3 + 3H_2O$
Часть атомов хлора принимает электроны, понижая степень окисления с 0 до -1 (хлор — окислитель).
Другая часть атомов хлора отдает электроны, повышая степень окисления с 0 до +5 (хлор — восстановитель).
Ответ: Элементарный хлор (Cl₂) может проявлять двойственные свойства, например, в реакции диспропорционирования с горячей щелочью, где он одновременно и окисляется, и восстанавливается.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 631 расположенного на странице 109 к сборнику задач 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №631 (с. 109), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.













