Номер 638, страница 110 - гдз по химии 8 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: голубой, зелёный с кристаллами
ISBN: 978-985-599-064-3
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава V. Окислительно-восстановительные реакции. Параграф 44. Окислительно-восстановительные реакции - номер 638, страница 110.
№638 (с. 110)
Условие. №638 (с. 110)
скриншот условия

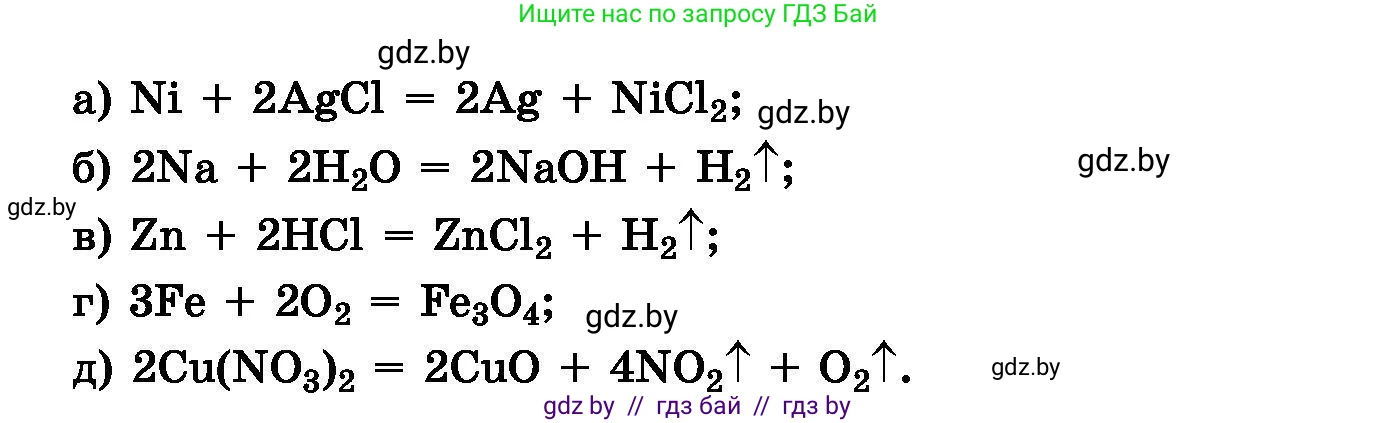
638. Определите степени окисления атомов всех химических элементов, укажите окислитель и восстановитель. Составьте схемы окисления и восстановления для следующих химических реакций:
a) $Ni + 2AgCl = 2Ag + NiCl_2;$
б) $2Na + 2H_2O = 2NaOH + H_2 \uparrow;$
в) $Zn + 2HCl = ZnCl_2 + H_2 \uparrow;$
г) $3Fe + 2O_2 = Fe_3O_4;$
д) $2Cu(NO_3)_2 = 2CuO + 4NO_2 \uparrow + O_2 \uparrow.$
Решение. №638 (с. 110)

Решение 2. №638 (с. 110)
а)
$\overset{0}{Ni} + 2\overset{+1}{Ag}\overset{-1}{Cl} = 2\overset{0}{Ag} + \overset{+2}{Ni}\overset{-1}{Cl_2}$
Степень окисления никеля ($Ni$) повышается с 0 до +2. Никель отдает электроны, окисляется и является восстановителем.
Степень окисления серебра ($Ag$) понижается с +1 до 0. Ион серебра $Ag^{+1}$ принимает электроны, восстанавливается. Хлорид серебра ($AgCl$) является окислителем.
Схемы окисления и восстановления:
$\overset{0}{Ni} - 2e^- \rightarrow \overset{+2}{Ni}$ | процесс окисления
$\overset{+1}{Ag} + 1e^- \rightarrow \overset{0}{Ag}$ | процесс восстановления
Ответ: $Ni$ (никель) - восстановитель; $AgCl$ (хлорид серебра) - окислитель.
б)
$2\overset{0}{Na} + 2\overset{+1}{H_2}\overset{-2}{O} = 2\overset{+1}{Na}\overset{-2}{O}\overset{+1}{H} + \overset{0}{H_2}\uparrow$
Степень окисления натрия ($Na$) повышается с 0 до +1. Натрий отдает электроны, окисляется и является восстановителем.
Степень окисления водорода ($H$) понижается с +1 до 0. Ион водорода $H^{+1}$ в составе воды принимает электроны, восстанавливается. Вода ($H_2O$) является окислителем.
Схемы окисления и восстановления:
$\overset{0}{Na} - 1e^- \rightarrow \overset{+1}{Na}$ | процесс окисления
$2\overset{+1}{H} + 2e^- \rightarrow \overset{0}{H_2}$ | процесс восстановления
Ответ: $Na$ (натрий) - восстановитель; $H_2O$ (вода) - окислитель.
в)
$\overset{0}{Zn} + 2\overset{+1}{H}\overset{-1}{Cl} = \overset{+2}{Zn}\overset{-1}{Cl_2} + \overset{0}{H_2}\uparrow$
Степень окисления цинка ($Zn$) повышается с 0 до +2. Цинк отдает электроны, окисляется и является восстановителем.
Степень окисления водорода ($H$) понижается с +1 до 0. Ион водорода $H^{+1}$ в составе соляной кислоты принимает электроны, восстанавливается. Соляная кислота ($HCl$) является окислителем.
Схемы окисления и восстановления:
$\overset{0}{Zn} - 2e^- \rightarrow \overset{+2}{Zn}$ | процесс окисления
$2\overset{+1}{H} + 2e^- \rightarrow \overset{0}{H_2}$ | процесс восстановления
Ответ: $Zn$ (цинк) - восстановитель; $HCl$ (соляная кислота) - окислитель.
г)
$3\overset{0}{Fe} + 2\overset{0}{O_2} = \overset{+8/3}{Fe_3}\overset{-2}{O_4}$
$Fe_3O_4$ (железная окалина) — это смешанный оксид $FeO \cdot Fe_2O_3$. В нём один атом железа имеет степень окисления +2, а два других — +3. Средняя степень окисления железа составляет +8/3.
Степень окисления железа ($Fe$) повышается с 0 до +8/3. Железо отдает электроны, окисляется и является восстановителем.
Степень окисления кислорода ($O$) понижается с 0 до -2. Кислород принимает электроны, восстанавливается и является окислителем.
Схемы окисления и восстановления:
$3\overset{0}{Fe} - 8e^- \rightarrow \overset{+2}{Fe} + 2\overset{+3}{Fe}$ (или $3\overset{0}{Fe} - 8e^- \rightarrow 3\overset{+8/3}{Fe}$) | процесс окисления
$\overset{0}{O_2} + 4e^- \rightarrow 2\overset{-2}{O}$ | процесс восстановления
Ответ: $Fe$ (железо) - восстановитель; $O_2$ (кислород) - окислитель.
д)
$2\overset{+2}{Cu}(\overset{+5}{N}\overset{-2}{O_3})_2 = 2\overset{+2}{Cu}\overset{-2}{O} + 4\overset{+4}{N}\overset{-2}{O_2}\uparrow + \overset{0}{O_2}\uparrow$
Это реакция внутримолекулярного окисления-восстановления, так как окислитель и восстановитель находятся в одном веществе. Степень окисления меди ($Cu$) не изменяется.
Степень окисления азота ($N$) понижается с +5 до +4. Азот $\overset{+5}{N}$ принимает электроны, восстанавливается и является окислителем.
Степень окисления кислорода ($O$) повышается с -2 до 0. Кислород $\overset{-2}{O}$ отдает электроны, окисляется и является восстановителем.
Схемы окисления и восстановления:
$\overset{+5}{N} + 1e^- \rightarrow \overset{+4}{N}$ | процесс восстановления (окислитель)
$2\overset{-2}{O} - 4e^- \rightarrow \overset{0}{O_2}$ | процесс окисления (восстановитель)
Ответ: Нитрат меди(II) ($Cu(NO_3)_2$) является одновременно и окислителем (за счет атома азота $\overset{+5}{N}$) и восстановителем (за счет атомов кислорода $\overset{-2}{O}$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 638 расположенного на странице 110 к сборнику задач 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №638 (с. 110), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.













