Номер 6, страница 19 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 1. Основные характеристики вещества. Параграф 3. Химические реакции - номер 6, страница 19.
№6 (с. 19)
Условие. №6 (с. 19)
скриншот условия

6. Составьте уравнение реакции алюминия с серной кислотой, в результате которой образуется сульфат алюминия и выделяется водород.
$2Al + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3H_2$
Решение. №6 (с. 19)
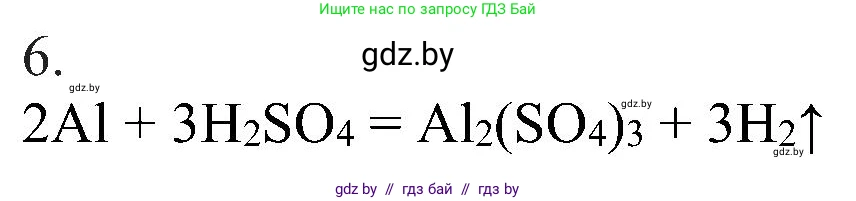
Решение 2. №6 (с. 19)
Для составления уравнения реакции взаимодействия алюминия с серной кислотой, в результате которой образуется сульфат алюминия и водород, необходимо выполнить следующие шаги:
1. Определение формул реагентов и продуктов.
- Реагенты: алюминий (простое вещество, металл) — $Al$; серная кислота — $H_2SO_4$.
- Продукты: сульфат алюминия (соль) и водород (газ). Алюминий в соединениях обычно проявляет степень окисления +3 ($Al^{3+}$), а сульфат-ион имеет заряд 2- ($SO_4^{2-}$). Чтобы составить формулу соли, необходимо уравнять суммарные заряды катионов и анионов. Наименьшее общее кратное для 3 и 2 равно 6. Следовательно, нам нужно 2 иона $Al^{3+}$ ($2 \times 3 = +6$) и 3 иона $SO_4^{2-}$ ($3 \times (-2) = -6$). Формула сульфата алюминия — $Al_2(SO_4)_3$. Водород является двухатомным газом, его формула — $H_2$.
2. Составление схемы реакции.
Запишем формулы реагентов слева от стрелки, а формулы продуктов — справа:
$Al + H_2SO_4 \rightarrow Al_2(SO_4)_3 + H_2$
3. Уравнивание (подбор коэффициентов).
Согласно закону сохранения массы, число атомов каждого элемента в левой части уравнения должно быть равно числу атомов этого же элемента в правой части. Подберем стехиометрические коэффициенты.
- Начнем с уравнивания атомов алюминия ($Al$). В правой части 2 атома алюминия, в левой — 1. Ставим коэффициент 2 перед $Al$:
$2Al + H_2SO_4 \rightarrow Al_2(SO_4)_3 + H_2$ - Теперь уравняем кислотные остатки (сульфат-группы $SO_4$). В правой части их 3, а в левой — 1. Ставим коэффициент 3 перед $H_2SO_4$:
$2Al + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + H_2$ - Далее уравниваем атомы водорода ($H$). В левой части их стало $3 \times 2 = 6$. В правой части — 2. Чтобы получить 6, ставим коэффициент 3 перед $H_2$:
$2Al + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3H_2$ - Проверим количество атомов кислорода ($O$). Слева $3 \times 4 = 12$ атомов, справа $3 \times 4 = 12$ атомов. Все элементы уравнены.
Ответ: Итоговое уравнение реакции: $2Al + 3H_2SO_4 = Al_2(SO_4)_3 + 3H_2\uparrow$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 6 расположенного на странице 19 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 19), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













