Номер 6, страница 167 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 4. Строение атома и периодичность изменения свойств атомов химических элементов и их соединений. Параграф 39. Периодичность изменения свойств атомов химических элементов - номер 6, страница 167.
№6 (с. 167)
Условие. №6 (с. 167)
скриншот условия

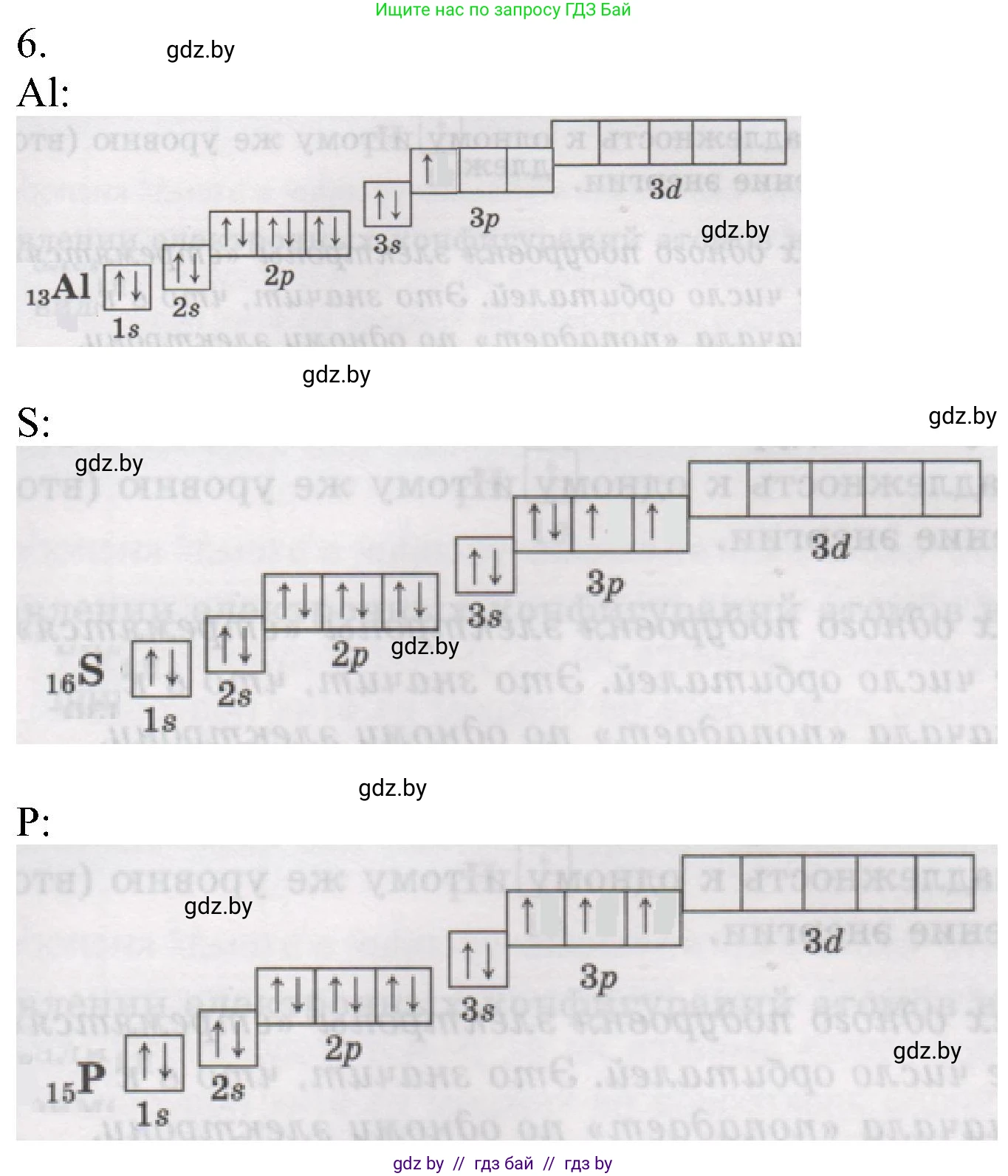
6. Составьте электронно-графические схемы атомов алюминия, серы и фосфора.
Решение. №6 (с. 167)
Решение 2. №6 (с. 167)
Алюминий
Алюминий ($Al$) — это химический элемент с атомным номером 13. Атом алюминия в основном состоянии содержит 13 протонов в ядре и 13 электронов на электронных оболочках.
Распределение электронов по энергетическим уровням и подуровням (электронная конфигурация) определяется принципом наименьшей энергии, принципом Паули и правилом Хунда. Электронная формула атома алюминия записывается следующим образом:
$1s^22s^22p^63s^23p^1$
Это означает, что на первом энергетическом уровне находятся 2 электрона ($1s^2$), на втором — 8 электронов ($2s^22p^6$), а на внешнем, третьем, уровне — 3 электрона ($3s^23p^1$).
Электронно-графическая схема наглядно показывает распределение электронов по атомным орбиталям (квантовым ячейкам). Каждая ячейка обозначается квадратом, а электроны — стрелками. Электроны с противоположными спинами (спаренные) изображаются стрелками, направленными в разные стороны (вверх и вниз).
Электронно-графическая схема атома алюминия ($_{13}Al$):
3p ↑
3s ↑↓
2p ↑↓↑↓↑↓
2s ↑↓
1s ↑↓
Ответ: Электронная конфигурация: $1s^22s^22p^63s^23p^1$.
Электронно-графическая схема:
3p ↑
3s ↑↓
(внутренние уровни $1s^22s^22p^6$ полностью заполнены).
Сера
Сера ($S$) — это химический элемент с атомным номером 16. Атом серы содержит 16 протонов и 16 электронов.
Электронная формула атома серы:
$1s^22s^22p^63s^23p^4$
На внешнем, третьем, энергетическом уровне находится 6 электронов ($3s^23p^4$). При заполнении $p$-подуровня, согласно правилу Хунда, сначала в каждую из трех $p$-орбиталей помещается по одному электрону, а четвертый электрон спаривается с одним из уже имеющихся.
Электронно-графическая схема атома серы ($_{16}S$):
3p ↑↓↑ ↑
3s ↑↓
2p ↑↓↑↓↑↓
2s ↑↓
1s ↑↓
Ответ: Электронная конфигурация: $1s^22s^22p^63s^23p^4$.
Электронно-графическая схема внешнего уровня:
3p ↑↓↑ ↑
3s ↑↓
Фосфор
Фосфор ($P$) — это химический элемент с атомным номером 15. Атом фосфора содержит 15 протонов и 15 электронов.
Электронная формула атома фосфора:
$1s^22s^22p^63s^23p^3$
На внешнем, третьем, энергетическом уровне находится 5 электронов ($3s^23p^3$). Согласно правилу Хунда, три электрона на $p$-подуровне занимают по одной орбитали, имея одинаковый (параллельный) спин.
Электронно-графическая схема атома фосфора ($_{15}P$):
3p ↑ ↑ ↑
3s ↑↓
2p ↑↓↑↓↑↓
2s ↑↓
1s ↑↓
Ответ: Электронная конфигурация: $1s^22s^22p^63s^23p^3$.
Электронно-графическая схема внешнего уровня:
3p ↑ ↑ ↑
3s ↑↓
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 6 расположенного на странице 167 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 167), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













