Готовимся к олимпиадам, страница 167 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 4. Строение атома и периодичность изменения свойств атомов химических элементов и их соединений. Параграф 39. Периодичность изменения свойств атомов химических элементов - страница 167.
Готовимся к олимпиадам (с. 167)
Условие. Готовимся к олимпиадам (с. 167)
скриншот условия

Готовимся к олимпиадам
1. Дополните схему и составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
$HNO_3 \rightarrow ? \rightarrow CaCO_3 \rightarrow ? \rightarrow HCl \rightarrow AlCl_3$.
Решение. Готовимся к олимпиадам (с. 167)
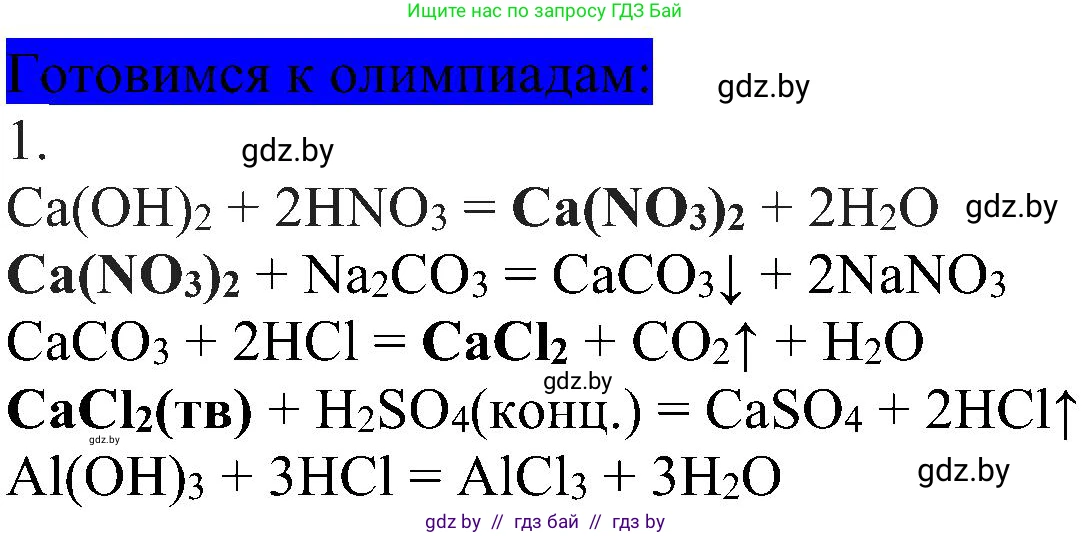
Решение 2. Готовимся к олимпиадам (с. 167)
Данную схему превращений можно дополнить следующими промежуточными веществами: нитратом кальция ($Ca(NO_3)_2$) и хлоридом кальция ($CaCl_2$).
Полная схема превращений выглядит так:
$HNO_3 \rightarrow Ca(NO_3)_2 \rightarrow CaCO_3 \rightarrow CaCl_2 \rightarrow HCl \rightarrow AlCl_3$
Ниже приведены уравнения реакций для осуществления этой цепи превращений.
1. Превращение $HNO_3 \rightarrow Ca(NO_3)_2$
Для получения нитрата кальция из азотной кислоты необходимо провести реакцию нейтрализации с основанием или основным оксидом, содержащим кальций. Например, с оксидом кальция:
$2HNO_3 + CaO \rightarrow Ca(NO_3)_2 + H_2O$
Также возможна реакция с гидроксидом кальция:
$2HNO_3 + Ca(OH)_2 \rightarrow Ca(NO_3)_2 + 2H_2O$
Ответ: $2HNO_3 + CaO \rightarrow Ca(NO_3)_2 + H_2O$
2. Превращение $Ca(NO_3)_2 \rightarrow CaCO_3$
Карбонат кальция является нерастворимой солью, поэтому его можно получить реакцией ионного обмена, добавив к раствору нитрата кальция раствор растворимого карбоната, например, карбоната натрия ($Na_2CO_3$) или карбоната калия ($K_2CO_3$). В результате реакции выпадает белый осадок карбоната кальция.
$Ca(NO_3)_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaNO_3$
Ответ: $Ca(NO_3)_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaNO_3$
3. Превращение $CaCO_3 \rightarrow CaCl_2$
Чтобы получить хлорид кальция из карбоната кальция, нужно подействовать на него сильной кислотой, содержащей хлорид-ион, например, соляной кислотой. При этом будет выделяться углекислый газ.
$CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2 \uparrow$
Ответ: $CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2 \uparrow$
4. Превращение $CaCl_2 \rightarrow HCl$
Соляную кислоту (а точнее, газообразный хлороводород) в лабораторных условиях получают, действуя на твердый хлорид (в данном случае, хлорид кальция) концентрированной нелетучей серной кислотой при нагревании.
$CaCl_2 (тв.) + H_2SO_4 (конц.) \xrightarrow{t} CaSO_4 + 2HCl \uparrow$
Ответ: $CaCl_2 + H_2SO_4 \rightarrow CaSO_4 + 2HCl$
5. Превращение $HCl \rightarrow AlCl_3$
Хлорид алюминия можно получить, растворяя в соляной кислоте металлический алюминий. Алюминий стоит в ряду активности металлов до водорода, поэтому он вытесняет водород из кислоты.
$2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2 \uparrow$
Альтернативными способами являются реакции соляной кислоты с оксидом алюминия или гидроксидом алюминия:
$Al_2O_3 + 6HCl \rightarrow 2AlCl_3 + 3H_2O$
$Al(OH)_3 + 3HCl \rightarrow AlCl_3 + 3H_2O$
Ответ: $2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2 \uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения Готовимся к олимпиадам расположенного на странице 167 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Готовимся к олимпиадам (с. 167), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













