Номер 2, страница 42 - гдз по химии 10 класс учебник Колевич, Матулис

Авторы: Колевич Т. А., Матулис В. Э., Матулис В. Э., Варакса И. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: синий
ISBN: 978-985-599-068-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 2. Углеводороды. Параграф 7. Пространственное строение молекул алканов. Гибридизация - номер 2, страница 42.
№2 (с. 42)
Условие. №2 (с. 42)
скриншот условия

2. Изобразите перекрывание электронных облаков в молекуле этана. Укажите приблизительные значения валентных углов в этой молекуле.
Решение. №2 (с. 42)
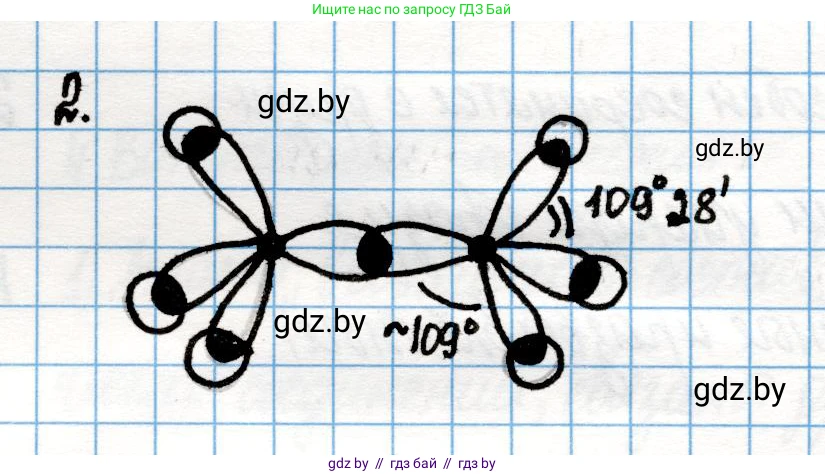
Решение 2. №2 (с. 42)
Решение
Молекула этана имеет химическую формулу $C_2H_6$ и структурную формулу $CH_3-CH_3$. В этой молекуле каждый атом углерода связан с тремя атомами водорода и одним другим атомом углерода, образуя четыре одинарные (сигма, $\sigma$) связи.
Для образования четырех связей атом углерода использует четыре валентных электрона. Электронная конфигурация атома углерода в основном состоянии — $1s^22s^22p^2$. В возбужденном состоянии один электрон с $2s$-подуровня переходит на $2p$-подуровень, и конфигурация становится $1s^22s^12p^3$. Одна $s$-орбиталь и три $p$-орбитали смешиваются (гибридизуются), образуя четыре равноценные по форме и энергии $sp^3$-гибридные орбитали. Эти орбитали направлены к вершинам тетраэдра, и угол между ними составляет приблизительно $109.5^\circ$. Атом водорода имеет один электрон на $1s$-орбитали сферической формы.
Образование связей в молекуле этана происходит за счет перекрывания электронных облаков:
- Связь C–C: Образуется путем осевого перекрывания двух $sp^3$-гибридных орбиталей, по одной от каждого атома углерода. Эта связь является $\sigma$-связью.
- Связи C–H: В молекуле шесть таких связей. Каждая из них образуется путем осевого перекрывания $sp^3$-гибридной орбитали атома углерода и $1s$-орбитали атома водорода. Это также $\sigma$-связи.
Ниже представлена схема перекрывания электронных облаков в молекуле этана.
Из-за $sp^3$-гибридизации атомов углерода молекула имеет тетраэдрическое строение у каждого углеродного центра. Все валентные углы (как H–C–H, так и H–C–C) близки к идеальному тетраэдрическому углу, который составляет $109.5^\circ$ или $109^\circ28'$. Небольшие отклонения от этого значения возможны из-за взаимного отталкивания атомов, но для общих целей используется именно это приблизительное значение.
Ответ:
В молекуле этана $C_2H_6$ каждый атом углерода находится в состоянии $sp^3$-гибридизации. Связь C–C образована перекрыванием двух $sp^3$-орбиталей ($\sigma$-связь). Шесть связей C–H образованы перекрыванием $sp^3$-орбитали углерода и $1s$-орбитали водорода ($\sigma$-связи). Геометрия у каждого атома углерода — тетраэдрическая. Приблизительные значения валентных углов H–C–H и H–C–C составляют $109.5^\circ$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 2 расположенного на странице 42 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 42), авторов: Колевич (Татьяна Александровна), Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Варакса (Игорь Николаевич), учебного пособия издательства Адукацыя i выхаванне.














