Номер 1, страница 72 - гдз по химии 10 класс учебник Колевич, Матулис

Авторы: Колевич Т. А., Матулис В. Э., Матулис В. Э., Варакса И. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: синий
ISBN: 978-985-599-068-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 2. Углеводороды. Параграф 12. Алкены. Строение молекул - номер 1, страница 72.
№1 (с. 72)
Условие. №1 (с. 72)
скриншот условия

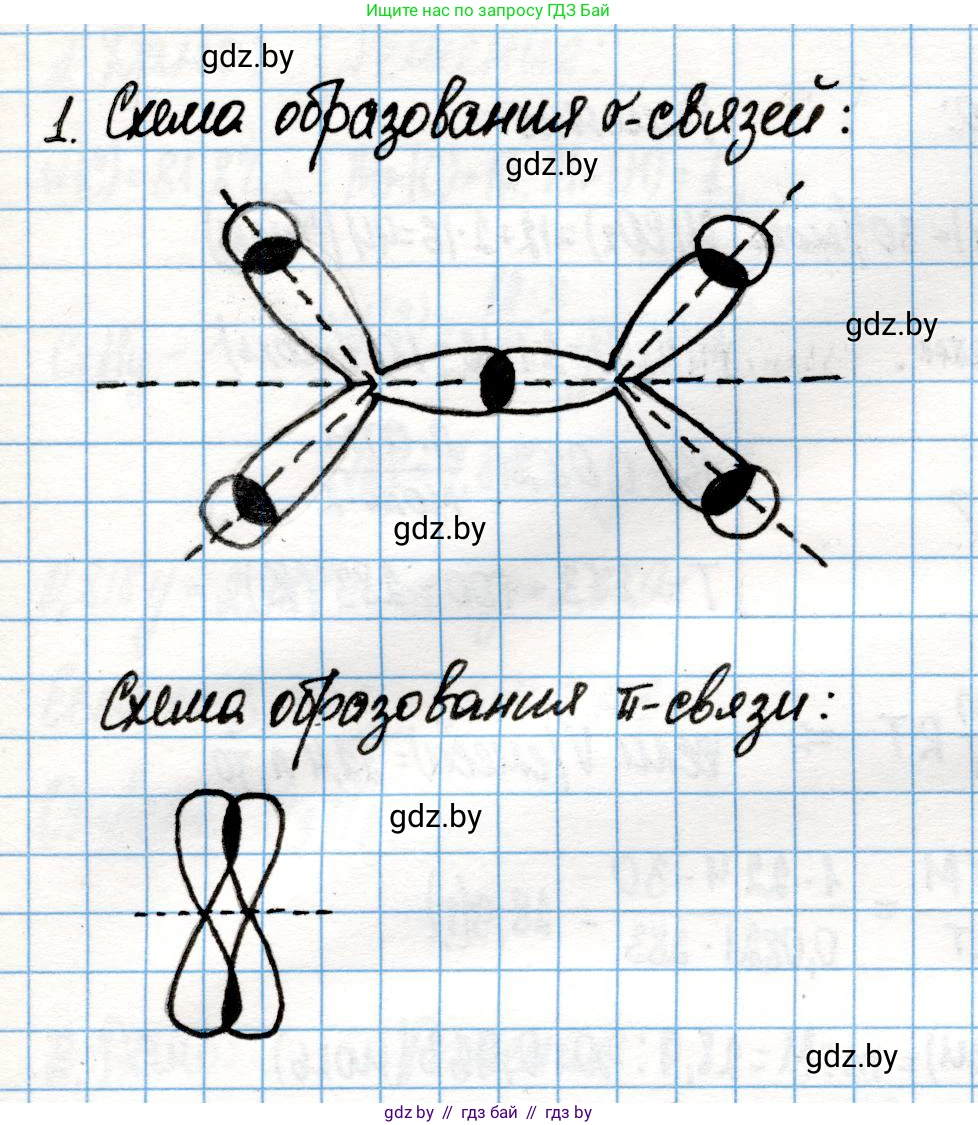
1. Нарисуйте схему перекрывания атомных орбиталей при образовании $\sigma$- и $\pi$-связей в молекуле этилена.
Решение. №1 (с. 72)
Решение 2. №1 (с. 72)
Решение
Молекула этилена (этена) имеет химическую формулу $C_2H_4$. В этой молекуле два атома углерода соединены друг с другом двойной связью ($C=C$), и каждый атом углерода связан с двумя атомами водорода. Для объяснения такого строения используется концепция гибридизации атомных орбиталей.
Каждый из двух атомов углерода в молекуле этилена находится в состоянии $sp^2$-гибридизации. Рассмотрим этот процесс:
- Атом углерода в основном состоянии имеет электронную конфигурацию $1s^2 2s^2 2p^2$.
- Для образования четырех связей атом переходит в возбужденное состояние, и один электрон с $2s$-орбитали переходит на свободную $2p$-орбиталь: $1s^2 2s^1 2p^3$.
- В процессе $sp^2$-гибридизации одна $s$-орбиталь и две $p$-орбитали смешиваются, образуя три одинаковые по форме и энергии гибридные $sp^2$-орбитали. Они располагаются в одной плоскости под углом 120° друг к другу.
- Одна $p$-орбиталь ($p_z$) остается негибридизованной и расположена перпендикулярно плоскости, в которой лежат гибридные орбитали.
Образование связей в молекуле этилена происходит следующим образом:
Образование $\sigma$-связей (сигма-связей)
$\sigma$-связи образуются путем осевого (лобового) перекрывания атомных орбиталей. В молекуле этилена всего 5 $\sigma$-связей:
- Одна $\sigma$-связь $C-C$: образуется в результате перекрывания по одной $sp^2$-гибридной орбитали от каждого атома углерода.
- Четыре $\sigma$-связи $C-H$: образуются в результате перекрывания двух оставшихся $sp^2$-гибридных орбиталей каждого атома углерода с $1s$-орбиталями четырех атомов водорода.
Все атомы в молекуле (2 атома углерода и 4 атома водорода) лежат в одной плоскости, образуя плоский $\sigma$-скелет молекулы.
Образование $\pi$-связи (пи-связи)
Двойная связь между атомами углерода состоит из одной $\sigma$- и одной $\pi$-связи.
- $\pi$-связь образуется в результате бокового (параллельного) перекрывания двух негибридизованных $p_z$-орбиталей, по одной от каждого атома углерода. Эти орбитали перпендикулярны плоскости молекулы.
- Области перекрывания находятся над и под плоскостью $\sigma$-связей, создавая единое электронное облако $\pi$-связи. Эта связь менее прочная, чем $\sigma$-связь, и определяет химическую реакционную способность алкенов.
Схема перекрывания орбиталей
На приведенной ниже схеме изображен процесс образования связей в молекуле этилена. Слева показано формирование $\sigma$-скелета за счет перекрывания $sp^2$-гибридных орбиталей углерода и $s$-орбиталей водорода. Справа показано боковое перекрывание негибридизованных $p$-орбиталей, которое приводит к образованию $\pi$-связи.
Ответ: В молекуле этилена ($C_2H_4$) между атомами углерода образуется одна $\sigma$-связь (перекрывание $sp^2-sp^2$ орбиталей) и одна $\pi$-связь (боковое перекрывание негибридных $p-p$ орбиталей). Каждый атом углерода также образует две $\sigma$-связи с атомами водорода (перекрывание $sp^2-s$ орбиталей). Всего в молекуле 5 $\sigma$-связей и 1 $\pi$-связь. $\sigma$-связи лежат в одной плоскости, а $\pi$-связь расположена перпендикулярно этой плоскости.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 1 расположенного на странице 72 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 72), авторов: Колевич (Татьяна Александровна), Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Варакса (Игорь Николаевич), учебного пособия издательства Адукацыя i выхаванне.














