Номер 81, страница 32 - гдз по химии 10 класс сборник задач Матулис, Матулис

Авторы: Матулис В. Э., Матулис В. Э., Колевич Т. А.
Тип: Сборник задач
Издательство: Национальный институт образования
Год издания: 2021 - 2025
Уровень обучения: базовый и повышенный
Цвет обложки: синий
ISBN: 978-985-594-959-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 1. Введение в органическую химию. 1.3. Химическая связь - номер 81, страница 32.
№81 (с. 32)
Условие. №81 (с. 32)
скриншот условия
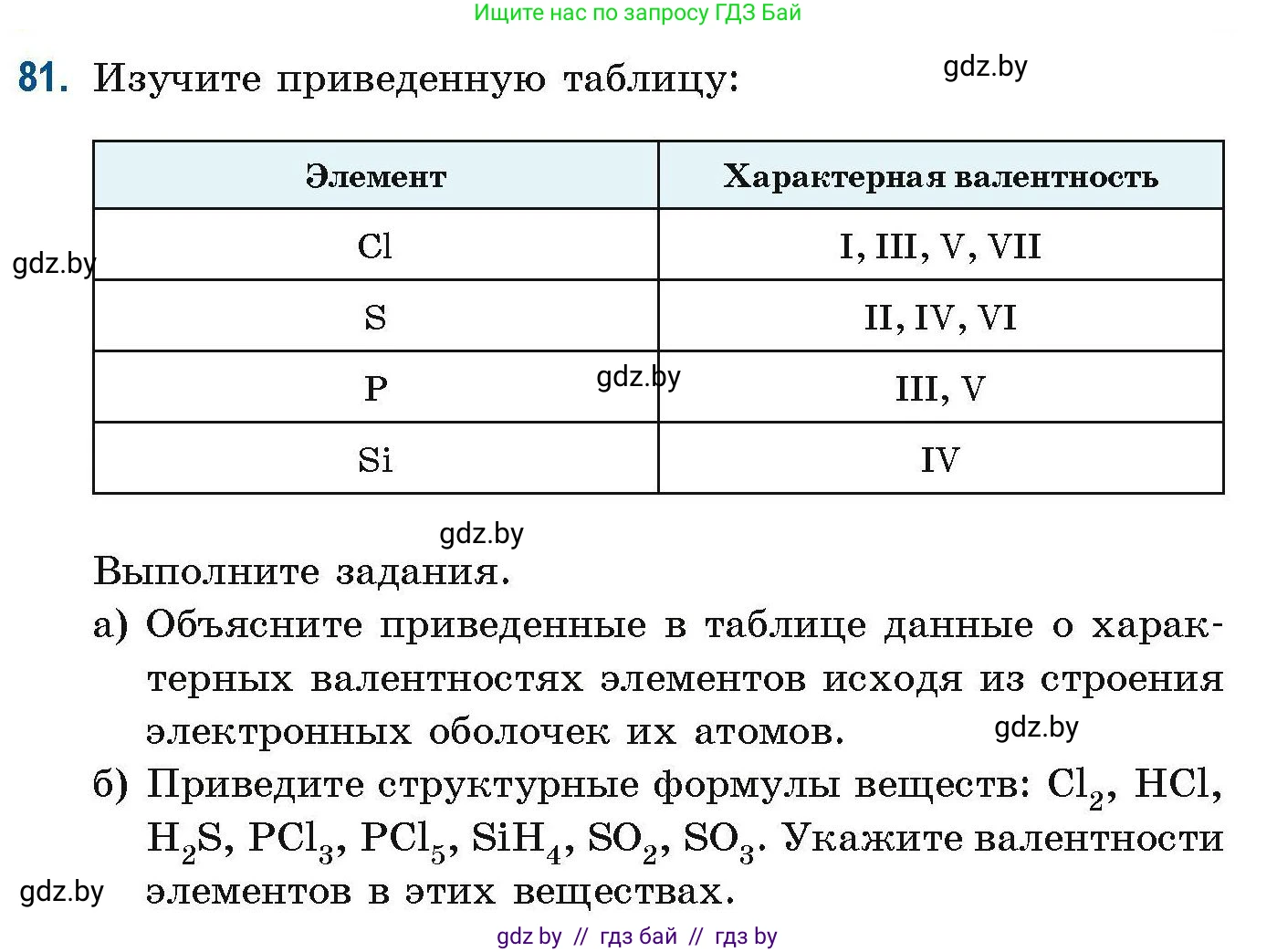
81. Изучите приведенную таблицу:
| Элемент | Характерная валентность |
|---|---|
| Cl | I, III, V, VII |
| S | II, IV, VI |
| P | III, V |
| Si | IV |
Выполните задания.
a) Объясните приведенные в таблице данные о характерных валентностях элементов исходя из строения электронных оболочек их атомов.
б) Приведите структурные формулы веществ: $Cl_2$, $HCl$, $H_2S$, $PCl_3$, $PCl_5$, $SiH_4$, $SO_2$, $SO_3$. Укажите валентности элементов в этих веществах.
Решение. №81 (с. 32)

Решение 2. №81 (с. 32)
а) Объяснение характерных валентностей элементов основано на строении их электронных оболочек, в частности, на количестве неспаренных электронов на внешнем энергетическом уровне в основном и возбужденном состояниях.
Хлор (Cl). Атом хлора имеет электронную конфигурацию $1s^22s^22p^63s^23p^5$. На внешнем уровне 7 валентных электронов ($3s^23p^5$).
В основном состоянии у атома хлора 1 неспаренный электрон, что обуславливает валентность I.
Атом хлора имеет свободные d-орбитали на третьем энергетическом уровне, поэтому он может переходить в возбужденные состояния. При распаривании одной p-электронной пары и переходе электрона на d-орбиталь, у атома становится 3 неспаренных электрона (валентность III).
При распаривании второй p-электронной пары образуется 5 неспаренных электронов (валентность V).
При распаривании s-электронной пары общее число неспаренных электронов становится 7 (валентность VII).
Сера (S). Атом серы имеет электронную конфигурацию $1s^22s^22p^63s^23p^4$. На внешнем уровне 6 валентных электронов ($3s^23p^4$).
В основном состоянии у атома серы 2 неспаренных электрона, что соответствует валентности II.
При переходе в первое возбужденное состояние (распаривание одной p-пары) атом серы имеет 4 неспаренных электрона (валентность IV).
При переходе во второе возбужденное состояние (распаривание s-пары) атом серы имеет 6 неспаренных электронов (валентность VI).
Фосфор (P). Атом фосфора имеет электронную конфигурацию $1s^22s^22p^63s^23p^3$. На внешнем уровне 5 валентных электронов ($3s^23p^3$).
В основном состоянии у атома фосфора 3 неспаренных электрона, что обуславливает валентность III.
При переходе в возбужденное состояние (распаривание s-пары) у атома становится 5 неспаренных электронов, что соответствует валентности V.
Кремний (Si). Атом кремния имеет электронную конфигурацию $1s^22s^22p^63s^23p^2$. На внешнем уровне 4 валентных электрона ($3s^23p^2$).
В основном состоянии у атома кремния 2 неспаренных электрона. Однако для кремния характерно возбужденное состояние.
При переходе в возбужденное состояние (один электрон с 3s-орбитали переходит на свободную 3p-орбиталь) атом кремния имеет 4 неспаренных электрона, что объясняет его постоянную и наиболее характерную валентность IV.
Ответ: Характерные валентности элементов, представленных в таблице, определяются числом неспаренных электронов, которые атом может предоставить для образования химических связей. Это число зависит от строения внешнего электронного слоя атома в основном и, для элементов 3-го периода (Cl, S, P, Si), в возбужденных состояниях, что и объясняет наличие у них нескольких возможных валентностей.
б)
$Cl_2$: структурная формула $Cl-Cl$. Валентность хлора (Cl) равна I.
$HCl$: структурная формула $H-Cl$. Валентность водорода (H) равна I, валентность хлора (Cl) равна I.
$H_2S$: структурная формула $H-S-H$. Валентность водорода (H) равна I, валентность серы (S) равна II.
$PCl_3$: структурная формула, в которой атом фосфора связан с тремя атомами хлора одинарными связями. Валентность фосфора (P) равна III, валентность хлора (Cl) равна I.
$PCl_5$: структурная формула, в которой атом фосфора связан с пятью атомами хлора одинарными связями. Валентность фосфора (P) равна V, валентность хлора (Cl) равна I.
$SiH_4$: структурная формула, в которой атом кремния связан с четырьмя атомами водорода одинарными связями. Валентность кремния (Si) равна IV, валентность водорода (H) равна I.
$SO_2$: структурная формула $O=S=O$. Валентность серы (S) равна IV, валентность кислорода (O) равна II.
$SO_3$: структурная формула, в которой атом серы связан с тремя атомами кислорода двойными связями. Валентность серы (S) равна VI, валентность кислорода (O) равна II.
Ответ: Структурные формулы веществ и валентности составляющих их элементов приведены выше.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 81 расположенного на странице 32 к сборнику задач 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №81 (с. 32), авторов: Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Колевич (Татьяна Александровна), базовый и повышенный уровень обучения учебного пособия издательства Национальный институт образования.














