Номер 1376, страница 213 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 7. Металлы. Параграф 47. Металлы IIA-группы периодической системы - номер 1376, страница 213.
№1376 (с. 213)
Условие. №1376 (с. 213)
скриншот условия

1376. Приведите молекулярные уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
а) $Be$ $→$ $BeO$ $→$ $Na_2BeO_2$ $→$ $BeCl_2$ $→$ $Be(OH)_2$ $→$ $Ba[Be(OH)_4]$;
б) $Mg$ $→$ $Mg_3N_2$ $→$ $MgBr_2$ $→$ $Mg(OH)_2$ $→$ $MgO$ $→$ $MgCl_2$ $→$ $Mg$;
в) $Ca(OH)_2$ $→$ $CaO$ $→$ $CaCl_2$ $→$ $Ca$ $→$ $CaC_2$ $→$ $Ca(OH)_2$ $→$ $Ca(H_2PO_4)_2$;
г) $Ba(OH)_2$ $→$ $Ba(HCO_3)_2$ $→$ $BaCO_3$ $→$ $BaO$ $→$ $Ba(NO_3)_2$ $→$ $BaO$.
Решение. №1376 (с. 213)

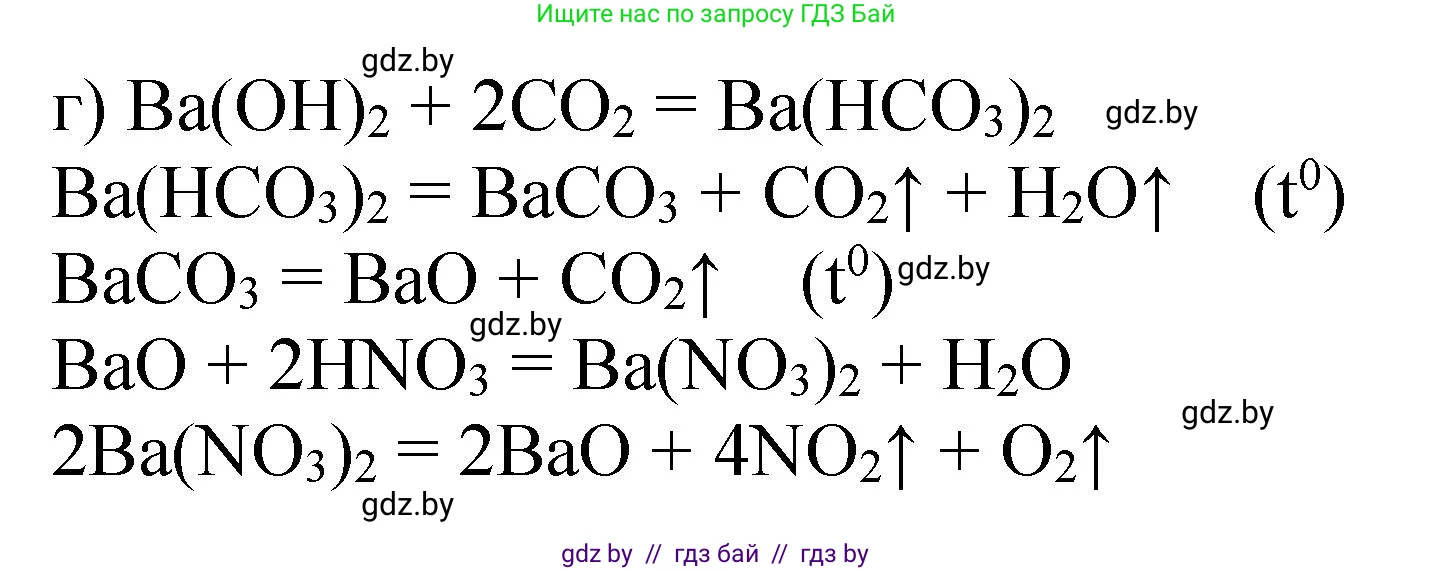
Решение 3. №1376 (с. 213)
а) $Be \rightarrow BeO \rightarrow Na_2BeO_2 \rightarrow BeCl_2 \rightarrow Be(OH)_2 \rightarrow Ba[Be(OH)_4]$
1. Получение оксида бериллия из бериллия достигается реакцией с кислородом при нагревании.
$2Be + O_2 \xrightarrow{t} 2BeO$
2. Оксид бериллия является амфотерным, поэтому он реагирует с твердым гидроксидом натрия при сплавлении с образованием бериллата натрия.
$BeO + 2NaOH \xrightarrow{сплавление} Na_2BeO_2 + H_2O$
3. Из бериллата натрия можно получить хлорид бериллия, подействовав на него избытком соляной кислоты.
$Na_2BeO_2 + 4HCl \rightarrow BeCl_2 + 2NaCl + 2H_2O$
4. Гидроксид бериллия получают из его соли (хлорида бериллия) путем реакции с раствором щелочи.
$BeCl_2 + 2NaOH \rightarrow Be(OH)_2\downarrow + 2NaCl$
5. Гидроксид бериллия также проявляет амфотерные свойства и реагирует с гидроксидом бария, образуя комплексную соль - тетрагидроксобериллат бария.
$Be(OH)_2 + Ba(OH)_2 \rightarrow Ba[Be(OH)_4]$
Ответ:
$2Be + O_2 \xrightarrow{t} 2BeO$
$BeO + 2NaOH \xrightarrow{сплавление} Na_2BeO_2 + H_2O$
$Na_2BeO_2 + 4HCl \rightarrow BeCl_2 + 2NaCl + 2H_2O$
$BeCl_2 + 2NaOH \rightarrow Be(OH)_2\downarrow + 2NaCl$
$Be(OH)_2 + Ba(OH)_2 \rightarrow Ba[Be(OH)_4]$
б) $Mg \rightarrow Mg_3N_2 \rightarrow MgBr_2 \rightarrow Mg(OH)_2 \rightarrow MgO \rightarrow MgCl_2 \rightarrow Mg$
1. Магний реагирует с азотом при нагревании, образуя нитрид магния.
$3Mg + N_2 \xrightarrow{t} Mg_3N_2$
2. Нитрид магния реагирует с бромоводородной кислотой, образуя бромид магния и аммиак.
$Mg_3N_2 + 6HBr \rightarrow 3MgBr_2 + 2NH_3\uparrow$
3. Гидроксид магния можно осадить из раствора бромида магния, добавив щелочь.
$MgBr_2 + 2KOH \rightarrow Mg(OH)_2\downarrow + 2KBr$
4. При нагревании гидроксид магния разлагается на оксид магния и воду.
$Mg(OH)_2 \xrightarrow{t} MgO + H_2O$
5. Оксид магния, как основный оксид, реагирует с соляной кислотой с образованием соли и воды.
$MgO + 2HCl \rightarrow MgCl_2 + H_2O$
6. Металлический магний получают электролизом расплава хлорида магния.
$MgCl_2 \xrightarrow{электролиз} Mg + Cl_2\uparrow$
Ответ:
$3Mg + N_2 \xrightarrow{t} Mg_3N_2$
$Mg_3N_2 + 6HBr \rightarrow 3MgBr_2 + 2NH_3\uparrow$
$MgBr_2 + 2KOH \rightarrow Mg(OH)_2\downarrow + 2KBr$
$Mg(OH)_2 \xrightarrow{t} MgO + H_2O$
$MgO + 2HCl \rightarrow MgCl_2 + H_2O$
$MgCl_2 \xrightarrow{электролиз} Mg + Cl_2\uparrow$
в) $Ca(OH)_2 \rightarrow CaO \rightarrow CaCl_2 \rightarrow Ca \rightarrow CaC_2 \rightarrow Ca(OH)_2 \rightarrow Ca(H_2PO_4)_2$
1. Оксид кальция получают термическим разложением гидроксида кальция.
$Ca(OH)_2 \xrightarrow{t} CaO + H_2O$
2. Оксид кальция реагирует с соляной кислотой, образуя хлорид кальция.
$CaO + 2HCl \rightarrow CaCl_2 + H_2O$
3. Металлический кальций получают электролизом расплава хлорида кальция.
$CaCl_2 \xrightarrow{электролиз} Ca + Cl_2\uparrow$
4. Карбид кальция образуется при реакции кальция с углем при высокой температуре.
$Ca + 2C \xrightarrow{t} CaC_2$
5. Гидроксид кальция получают при гидролизе карбида кальция.
$CaC_2 + 2H_2O \rightarrow Ca(OH)_2 + C_2H_2\uparrow$
6. Дигидрофосфат кальция получают реакцией гидроксида кальция с избытком ортофосфорной кислоты.
$Ca(OH)_2 + 2H_3PO_4 \rightarrow Ca(H_2PO_4)_2 + 2H_2O$
Ответ:
$Ca(OH)_2 \xrightarrow{t} CaO + H_2O$
$CaO + 2HCl \rightarrow CaCl_2 + H_2O$
$CaCl_2 \xrightarrow{электролиз} Ca + Cl_2\uparrow$
$Ca + 2C \xrightarrow{t} CaC_2$
$CaC_2 + 2H_2O \rightarrow Ca(OH)_2 + C_2H_2\uparrow$
$Ca(OH)_2 + 2H_3PO_4 \rightarrow Ca(H_2PO_4)_2 + 2H_2O$
г) $Ba(OH)_2 \rightarrow Ba(HCO_3)_2 \rightarrow BaCO_3 \rightarrow BaO \rightarrow Ba(NO_3)_2 \rightarrow BaO$
1. При пропускании избытка углекислого газа через раствор гидроксида бария образуется кислая соль - гидрокарбонат бария.
$Ba(OH)_2 + 2CO_2 \rightarrow Ba(HCO_3)_2$
2. При нагревании раствора гидрокарбонат бария разлагается с образованием нерастворимого карбоната бария.
$Ba(HCO_3)_2 \xrightarrow{t} BaCO_3\downarrow + H_2O + CO_2\uparrow$
3. Оксид бария получают прокаливанием карбоната бария при высокой температуре.
$BaCO_3 \xrightarrow{t} BaO + CO_2\uparrow$
4. Оксид бария реагирует с азотной кислотой, образуя нитрат бария.
$BaO + 2HNO_3 \rightarrow Ba(NO_3)_2 + H_2O$
5. Термическое разложение нитрата бария приводит к образованию оксида бария, диоксида азота и кислорода.
$2Ba(NO_3)_2 \xrightarrow{t} 2BaO + 4NO_2\uparrow + O_2\uparrow$
Ответ:
$Ba(OH)_2 + 2CO_2 \rightarrow Ba(HCO_3)_2$
$Ba(HCO_3)_2 \xrightarrow{t} BaCO_3\downarrow + H_2O + CO_2\uparrow$
$BaCO_3 \xrightarrow{t} BaO + CO_2\uparrow$
$BaO + 2HNO_3 \rightarrow Ba(NO_3)_2 + H_2O$
$2Ba(NO_3)_2 \xrightarrow{t} 2BaO + 4NO_2\uparrow + O_2\uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1376 расположенного на странице 213 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1376 (с. 213), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














