Номер 249, страница 43 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 2. Строение атома и периодический закон. Параграф 10. Периодический закон в свете теории строения атома - номер 249, страница 43.
№249 (с. 43)
Условие. №249 (с. 43)
скриншот условия

249. Составьте электронные формулы атомов, находящихся в соответствующих валентных состояниях: сера(VI), магний(II), фосфор(V), хлор(VII), бериллий(II).
Решение. №249 (с. 43)
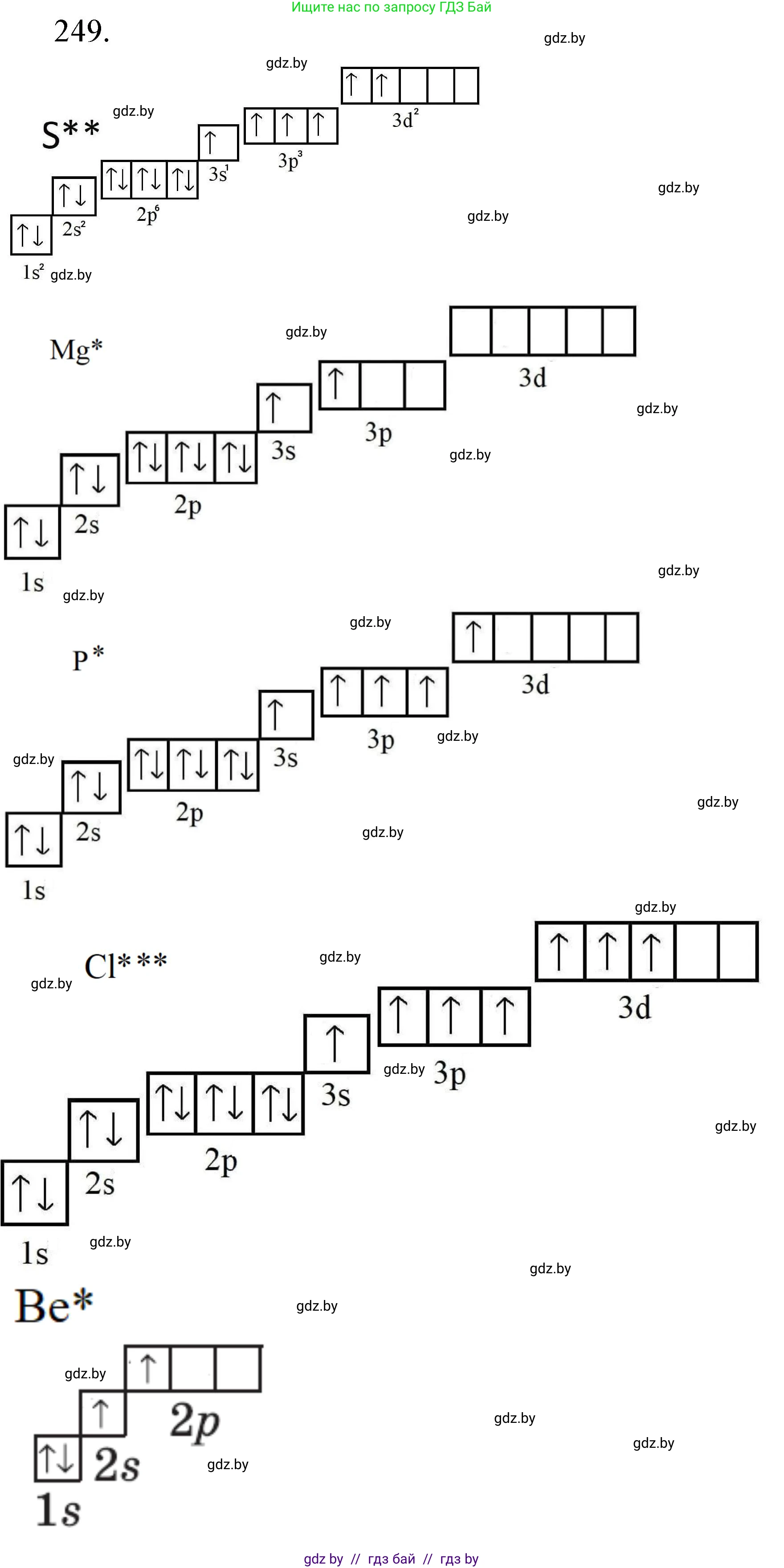
Решение 3. №249 (с. 43)
Электронная формула атома в определенном валентном состоянии отражает конфигурацию его валентных электронов в возбужденном состоянии, когда число неспаренных электронов становится равным данной валентности. Это происходит за счет перехода электронов с более низких энергетических подуровней на свободные орбитали более высоких подуровней в пределах одного энергетического уровня.
сера(VI)
Атом серы S имеет порядковый номер 16. Электронная конфигурация в основном (невозбужденном) состоянии: $1s^22s^22p^63s^23p^4$. Валентные электроны находятся на третьем энергетическом уровне: $3s^23p^4$. В основном состоянии у серы 2 неспаренных электрона, что соответствует валентности II.
Для проявления валентности VI атому серы необходимо иметь 6 неспаренных электронов. Это достигается в возбужденном состоянии (S*) путем перехода одного электрона с 3s-подуровня и одного электрона с 3p-подуровня на свободный 3d-подуровня:
$S(3s^23p^4) \rightarrow S^*(3s^13p^33d^2)$
В результате на внешнем уровне образуется 6 неспаренных электронов (один на 3s, три на 3p и два на 3d орбиталях).
Полная электронная формула возбужденного атома серы(VI): $1s^22s^22p^63s^13p^33d^2$.
Ответ: $1s^22s^22p^63s^13p^33d^2$.
магний(II)
Атом магния Mg имеет порядковый номер 12. Электронная конфигурация в основном состоянии: $1s^22s^22p^63s^2$. Валентные электроны: $3s^2$. В основном состоянии у магния нет неспаренных электронов.
Для проявления валентности II атому магния необходимо иметь 2 неспаренных электрона. Это достигается при переходе одного электрона с 3s-подуровня на вакантный 3p-подуровень:
$Mg(3s^2) \rightarrow Mg^*(3s^13p^1)$
В возбужденном состоянии образуется 2 неспаренных электрона.
Полная электронная формула возбужденного атома магния(II): $1s^22s^22p^63s^13p^1$.
Ответ: $1s^22s^22p^63s^13p^1$.
фосфор(V)
Атом фосфора P имеет порядковый номер 15. Электронная конфигурация в основном состоянии: $1s^22s^22p^63s^23p^3$. Валентные электроны: $3s^23p^3$. В основном состоянии у фосфора 3 неспаренных электрона (валентность III).
Для проявления валентности V атому фосфора необходимо иметь 5 неспаренных электронов. Это достигается при распаривании электронной пары на 3s-подуровне и переходе одного электрона на свободный 3d-подуровень:
$P(3s^23p^3) \rightarrow P^*(3s^13p^33d^1)$
В результате на внешнем уровне образуется 5 неспаренных электронов.
Полная электронная формула возбужденного атома фосфора(V): $1s^22s^22p^63s^13p^33d^1$.
Ответ: $1s^22s^22p^63s^13p^33d^1$.
хлор(VII)
Атом хлора Cl имеет порядковый номер 17. Электронная конфигурация в основном состоянии: $1s^22s^22p^63s^23p^5$. Валентные электроны: $3s^23p^5$. В основном состоянии у хлора 1 неспаренный электрон (валентность I).
Для проявления высшей валентности VII атому хлора необходимо иметь 7 неспаренных электронов. Это возможно в возбужденном состоянии при последовательном распаривании всех электронных пар внешнего уровня ($3s^2$, $3p^4$) и переходе электронов на свободный 3d-подуровень:
$Cl(3s^23p^5) \rightarrow Cl^*(3s^13p^33d^3)$
В результате на внешнем уровне образуется 7 неспаренных электронов (один на 3s, три на 3p и три на 3d орбиталях).
Полная электронная формула возбужденного атома хлора(VII): $1s^22s^22p^63s^13p^33d^3$.
Ответ: $1s^22s^22p^63s^13p^33d^3$.
бериллий(II)
Атом бериллия Be имеет порядковый номер 4. Электронная конфигурация в основном состоянии: $1s^22s^2$. Валентные электроны: $2s^2$. В основном состоянии у бериллия нет неспаренных электронов.
Для проявления валентности II атому бериллия необходимо иметь 2 неспаренных электрона. Это достигается при переходе одного электрона с 2s-подуровня на вакантный 2p-подуровень:
$Be(2s^2) \rightarrow Be^*(2s^12p^1)$
В возбужденном состоянии образуется 2 неспаренных электрона.
Полная электронная формула возбужденного атома бериллия(II): $1s^22s^12p^1$.
Ответ: $1s^22s^12p^1$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 249 расположенного на странице 43 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №249 (с. 43), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














