Номер 343, страница 54 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 3. Химическая связь и строение вещества. Параграф 13. Природа и типы химической связи - номер 343, страница 54.
№343 (с. 54)
Условие. №343 (с. 54)
скриншот условия

343. Между какими из атомов может существовать ионная связь:
а) натрий и сера;
б) хлор и кислород;
в) селен и фтор;
г) кальций и кислород;
д) магний и йод;
е) ксенон и кислород;
ж) алюминий и водород;
з) литий и азот?
Решение. №343 (с. 54)
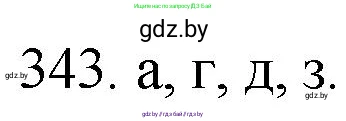
Решение 3. №343 (с. 54)
Ионная химическая связь возникает в результате электростатического притяжения между противоположно заряженными ионами (катионами и анионами). Она образуется, как правило, между атомами типичных металлов и типичных неметаллов. Главным критерием для образования ионной связи является большая разница в электроотрицательности (ЭО) между атомами (условно, $ΔЭО > 1.7$). Металл, обладающий низкой ЭО, отдает свои валентные электроны, превращаясь в катион, а неметалл с высокой ЭО принимает эти электроны, превращаясь в анион.
а) натрий и сера;
Натрий ($Na$) — это щелочной металл (I группа главной подгруппы), а сера ($S$) — типичный неметалл (VI группа главной подгруппы). Разница их электроотрицательностей значительна ($ΔЭО = ЭО(S) - ЭО(Na) ≈ 2.58 - 0.93 = 1.65$). Атом натрия легко отдает один электрон, образуя катион $Na^+$, а атом серы, стремясь завершить свой внешний электронный слой, принимает два электрона, образуя анион $S^{2-}$. Возникающее между ними соединение — сульфид натрия ($Na_2S$) — является ионным.
Ответ: да, между атомами натрия и серы может существовать ионная связь.
б) хлор и кислород;
И хлор ($Cl$), и кислород ($O$) являются типичными неметаллами с высокой электроотрицательностью. Разница их ЭО мала ($ΔЭО = |ЭО(O) - ЭО(Cl)| ≈ |3.44 - 3.16| = 0.28$). При такой незначительной разнице электроны не переходят от одного атома к другому, а образуют общие электронные пары. Связь между хлором и кислородом является ковалентной полярной.
Ответ: нет, между атомами хлора и кислорода существует ковалентная полярная связь.
в) селен и фтор;
Селен ($Se$) и фтор ($F$) — это неметаллы. Хотя фтор является самым электроотрицательным элементом, а разница ЭО с селеном существенна ($ΔЭО = ЭО(F) - ЭО(Se) ≈ 3.98 - 2.55 = 1.43$), этого недостаточно для полного перехода электронов. Связь в соединениях селена с фтором (например, $SeF_6$) является ковалентной сильнополярной.
Ответ: нет, между атомами селена и фтора существует ковалентная полярная связь.
г) кальций и кислород;
Кальций ($Ca$) — типичный щелочноземельный металл (II группа), а кислород ($O$) — один из самых электроотрицательных неметаллов (VI группа). Разница их электроотрицательностей очень велика ($ΔЭО = ЭО(O) - ЭО(Ca) ≈ 3.44 - 1.00 = 2.44$). Это приводит к полному переходу двух электронов от атома кальция к атому кислорода с образованием катиона $Ca^{2+}$ и аниона $O^{2-}$. Соединение оксид кальция ($CaO$) является классическим примером вещества с ионной связью.
Ответ: да, между атомами кальция и кислорода может существовать ионная связь.
д) магний и йод;
Магний ($Mg$) — щелочноземельный металл (II группа), а йод ($I$) — неметалл-галоген (VII группа). Разница их ЭО ($ΔЭО = ЭО(I) - ЭО(Mg) ≈ 2.66 - 1.31 = 1.35$) находится в пограничной области. Однако, как и для большинства соединений активных металлов с галогенами, связь в иодиде магния ($MgI_2$) считается преимущественно ионной. Магний образует катион $Mg^{2+}$, а йод — анион $I^-$.
Ответ: да, между атомами магния и йода может существовать ионная связь.
е) ксенон и кислород;
Ксенон ($Xe$) — инертный газ, а кислород ($O$) — неметалл. Несмотря на то что ксенон способен образовывать химические соединения, он обладает достаточно высокой электроотрицательностью. Разница ЭО с кислородом невелика ($ΔЭО = |ЭО(O) - ЭО(Xe)| ≈ |3.44 - 2.60| = 0.84$). Связи в оксидах ксенона (например, $XeO_3$) являются ковалентными полярными.
Ответ: нет, между атомами ксенона и кислорода существует ковалентная полярная связь.
ж) алюминий и водород;
Алюминий ($Al$) является металлом, а водород ($H$) — неметаллом. Однако разница их электроотрицательностей мала ($ΔЭО = ЭО(H) - ЭО(Al) ≈ 2.20 - 1.61 = 0.59$). Ионная связь в гидридах характерна только для самых активных металлов (щелочных и щелочноземельных). Связь в гидриде алюминия ($AlH_3$) считается ковалентной полярной.
Ответ: нет, между атомами алюминия и водорода существует ковалентная полярная связь.
з) литий и азот;
Литий ($Li$) — щелочной металл (I группа), а азот ($N$) — активный неметалл (V группа). Разница их электроотрицательностей очень велика ($ΔЭО = ЭО(N) - ЭО(Li) ≈ 3.04 - 0.98 = 2.06$). Это приводит к образованию ионной связи. Три атома лития отдают по одному электрону, образуя катионы $Li^+$, а один атом азота принимает три электрона, образуя анион $N^{3-}$. Соединение нитрид лития ($Li_3N$) является ионным.
Ответ: да, между атомами лития и азота может существовать ионная связь.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 343 расположенного на странице 54 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №343 (с. 54), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














