Номер 467, страница 71 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 4. Химические реакции. Параграф 18. Классификация и общие характеристики химических реакций - номер 467, страница 71.
№467 (с. 71)
Условие. №467 (с. 71)
скриншот условия

467. Укажите верные утверждения:
а) в окислительно-восстановительных реакциях изменяется электроотрицательность атомов;
б) в реакции замещения реагентами являются два сложных вещества;
в) при разложении сложного вещества может образоваться много простых и сложных веществ;
г) под действием $MnO_2$ вода разлагается на водород и кислород;
д) реакции между твёрдыми веществами всегда являются гетерогенными;
е) электронный баланс — это равенство числа электронов в исходных веществах и продуктах;
ж) реакции обмена не являются окислительно-восстановительными;
з) все реакции разложения являются экзотермическими.
Решение. №467 (с. 71)
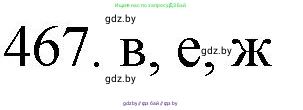
Решение 3. №467 (с. 71)
а) в окислительно-восстановительных реакциях изменяется электроотрицательность атомов;
Данное утверждение неверно. Электроотрицательность – это фундаментальная характеристика атома химического элемента, которая показывает его способность притягивать к себе электроны от других атомов в химической связи. Эта величина является постоянной для каждого элемента. В ходе окислительно-восстановительных реакций (ОВР) изменяются степени окисления атомов, так как происходит переход электронов от одного атома (восстановителя) к другому (окислителю), но не их электроотрицательность.
Ответ: утверждение неверно.
б) в реакции замещения реагентами являются два сложных вещества;
Данное утверждение неверно. Классическая реакция замещения – это реакция, в которой атомы простого вещества замещают атомы одного из элементов в сложном веществе. Таким образом, реагентами являются одно простое и одно сложное вещество. Например, реакция цинка с соляной кислотой: $Zn \text{ (простое)} + 2HCl \text{ (сложное)} \rightarrow ZnCl_2 + H_2$. Реакция между двумя сложными веществами, при которой они обмениваются своими составными частями, называется реакцией обмена, а не замещения.
Ответ: утверждение неверно.
в) при разложении сложного вещества может образоваться много простых и сложных веществ;
Данное утверждение верно. Реакция разложения — это процесс, в результате которого из одного сложного вещества образуется два или более новых веществ. Продуктами могут быть как простые, так и сложные вещества. Например, при разложении дихромата аммония образуются три вещества — два сложных (оксид хрома(III) и вода) и одно простое (азот): $(NH_4)_2Cr_2O_7 \rightarrow Cr_2O_3 + N_2 \uparrow + 4H_2O$.
Ответ: утверждение верно.
г) под действием $MnO_2$ вода разлагается на водород и кислород;
Данное утверждение неверно. Оксид марганца(IV) ($MnO_2$) является катализатором для разложения пероксида водорода ($H_2O_2$), а не воды ($H_2O$). Реакция разложения пероксида водорода: $2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2 \uparrow$. Разложение воды на водород и кислород происходит, например, под действием электрического тока (электролиз).
Ответ: утверждение неверно.
д) реакции между твёрдыми веществами всегда являются гетерогенными;
Данное утверждение верно. Гетерогенные реакции протекают на границе раздела фаз. Когда реагируют два или более твёрдых вещества, они находятся в одной (твёрдой) фазе, но реакция происходит только на поверхности их соприкосновения. Поскольку существует поверхность раздела между частицами разных веществ, такая система является гетерогенной, и реакция соответственно тоже.
Ответ: утверждение верно.
е) электронный баланс — это равенство числа электронов в исходных веществах и продуктах;
Данное утверждение неверно. Это некорректное определение. Метод электронного баланса, используемый для расстановки коэффициентов в ОВР, основан на принципе, что число электронов, отданных восстановителем в процессе окисления, должно быть равно числу электронов, принятых окислителем в процессе восстановления. Утверждение же в задании скорее описывает закон сохранения заряда (и материи), который выполняется для любой реакции, а не суть метода электронного баланса.
Ответ: утверждение неверно.
ж) реакции обмена не являются окислительно-восстановительными;
Данное утверждение в общем случае верно. В реакциях ионного обмена (нейтрализация, осаждение) происходит обмен ионами между сложными веществами, при этом степени окисления элементов, как правило, не изменяются. Например: $BaCl_2 + Na_2SO_4 \rightarrow BaSO_4 \downarrow + 2NaCl$. Здесь все элементы сохраняют свои степени окисления. Хотя существуют редчайшие исключения, в рамках школьного и общего курса химии это утверждение считается правилом.
Ответ: утверждение верно.
з) все реакции разложения являются экзотермическими.
Данное утверждение неверно. Большинство реакций разложения являются эндотермическими, так как для разрыва существующих химических связей в исходном веществе требуется затратить энергию (обычно в виде тепла). Например, разложение карбоната кальция: $CaCO_3 \xrightarrow{t^\circ} CaO + CO_2$. Существуют и экзотермические реакции разложения (например, разложение пероксида водорода), но слово «все» делает утверждение ложным.
Ответ: утверждение неверно.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 467 расположенного на странице 71 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №467 (с. 71), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














