Номер 761, страница 127 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 6. Неметаллы. Параграф 28. Общая характеристика неметаллов - номер 761, страница 127.
№761 (с. 127)
Условие. №761 (с. 127)
скриншот условия
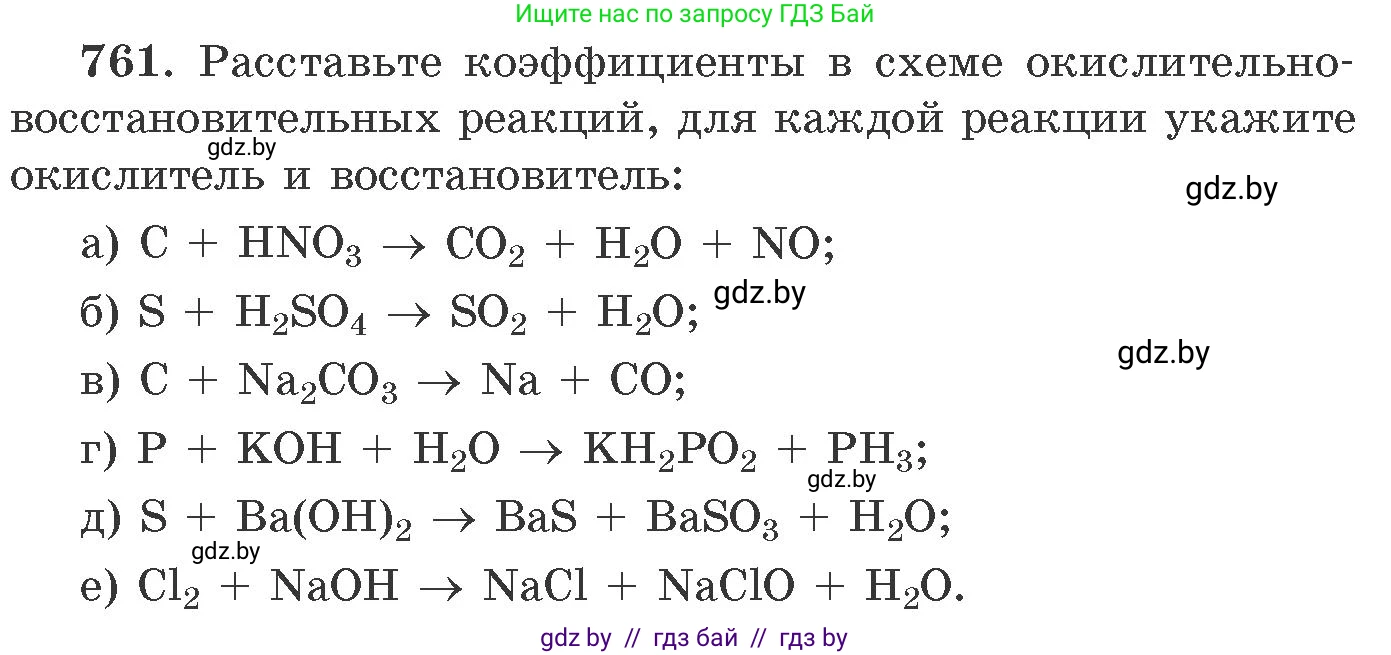
761. Расставьте коэффициенты в схеме окислительно-восстановительных реакций, для каждой реакции укажите окислитель и восстановитель:
а) $C + HNO_3 \rightarrow CO_2 + H_2O + NO;$
б) $S + H_2SO_4 \rightarrow SO_2 + H_2O;$
в) $C + Na_2CO_3 \rightarrow Na + CO;$
г) $P + KOH + H_2O \rightarrow KH_2PO_2 + PH_3;$
д) $S + Ba(OH)_2 \rightarrow BaS + BaSO_3 + H_2O;$
е) $Cl_2 + NaOH \rightarrow NaCl + NaClO + H_2O.$
Решение. №761 (с. 127)

Решение 3. №761 (с. 127)
а) C + HNO₃ → CO₂ + H₂O + NO
Решение:
Для начала определим степени окисления элементов в реагентах и продуктах: $C^0 + H^{+1}N^{+5}O^{-2}_3 \rightarrow C^{+4}O^{-2}_2 + H^{+1}_2O^{-2} + N^{+2}O^{-2}$.
Видно, что углерод ($C$) повышает свою степень окисления с 0 до +4, то есть окисляется и является восстановителем. Азот ($N$) понижает свою степень окисления с +5 до +2, то есть восстанавливается, а вещество $HNO_3$ является окислителем.
Составим электронный баланс:
$C^0 - 4e^- \rightarrow C^{+4} \quad | \space 3$ (процесс окисления)
$N^{+5} + 3e^- \rightarrow N^{+2} \quad | \space 4$ (процесс восстановления)
Наименьшее общее кратное для чисел отданных и принятых электронов (4 и 3) равно 12. Поэтому первый процесс домножаем на 3, а второй — на 4. Эти числа и будут коэффициентами перед соответствующими веществами.
$3C + 4HNO_3 \rightarrow 3CO_2 + H_2O + 4NO$
Теперь уравняем количество атомов водорода и кислорода. Слева 4 атома водорода, значит перед $H_2O$ ставим коэффициент 2. Проверяем кислород: слева $4 \times 3 = 12$ атомов, справа $3 \times 2 + 2 + 4 = 12$ атомов. Все атомы уравнены.
Ответ: $3C + 4HNO_3 \rightarrow 3CO_2 + 2H_2O + 4NO$. Окислитель — $HNO_3$ (за счет $N^{+5}$), восстановитель — $C$ (за счет $C^0$).
б) S + H₂SO₄ → SO₂ + H₂O
Решение:
Определим степени окисления: $S^0 + H^{+1}_2S^{+6}O^{-2}_4 \rightarrow S^{+4}O^{-2}_2 + H^{+1}_2O^{-2}$.
Это реакция сопропорционирования. Сера ($S^0$) окисляется до $S^{+4}$ и является восстановителем. Сера ($S^{+6}$) в серной кислоте восстанавливается до $S^{+4}$, следовательно, $H_2SO_4$ — окислитель.
Составим электронный баланс:
$S^0 - 4e^- \rightarrow S^{+4} \quad | \space 1$ (окисление)
$S^{+6} + 2e^- \rightarrow S^{+4} \quad | \space 2$ (восстановление)
Умножаем второе уравнение на 2, чтобы уравнять число электронов. Получаем коэффициенты: 1 для $S$ и 2 для $H_2SO_4$. В продуктах образуется $1+2=3$ молекулы $SO_2$.
$S + 2H_2SO_4 \rightarrow 3SO_2 + H_2O$
Уравняем водород: слева $2 \times 2 = 4$ атома, значит справа перед $H_2O$ ставим 2. Проверяем кислород: слева $2 \times 4 = 8$, справа $3 \times 2 + 2 = 8$.
Ответ: $S + 2H_2SO_4 \rightarrow 3SO_2 + 2H_2O$. Окислитель — $H_2SO_4$ (за счет $S^{+6}$), восстановитель — $S$ (за счет $S^0$).
в) C + Na₂CO₃ → Na + CO
Решение:
Определим степени окисления: $C^0 + Na^{+1}_2C^{+4}O^{-2}_3 \rightarrow Na^0 + C^{+2}O^{-2}$.
Углерод ($C^0$) окисляется до $C^{+2}$ и является восстановителем. Натрий ($Na^{+1}$) восстанавливается до $Na^0$, а также углерод из карбоната ($C^{+4}$) восстанавливается до $C^{+2}$. Таким образом, $Na_2CO_3$ является окислителем.
Составим электронный баланс:
$C^0 - 2e^- \rightarrow C^{+2}$ (окисление)
$2Na^{+1} + 2e^- \rightarrow 2Na^0$ (восстановление)
$C^{+4} + 2e^- \rightarrow C^{+2}$ (восстановление)
Чтобы сбалансировать общее число отданных и принятых электронов, на 2 отданных электрона от одного атома $C^0$ должно приходиться 4 принятых электрона (2 на $2Na^{+1}$ и 2 на $C^{+4}$). Поэтому возьмем 2 атома $C^0$.
$2C^0 - 4e^- \rightarrow 2C^{+2}$
$2Na^{+1} + C^{+4} + 4e^- \rightarrow 2Na^0 + C^{+2}$
Отсюда получаем коэффициенты: 2 перед $C$, 1 перед $Na_2CO_3$, 2 перед $Na$ и $2+1=3$ перед $CO$.
$2C + Na_2CO_3 \rightarrow 2Na + 3CO$
Проверка: C: $2+1=3$ слева, 3 справа. Na: 2 слева, 2 справа. O: 3 слева, 3 справа.
Ответ: $2C + Na_2CO_3 \rightarrow 2Na + 3CO$. Окислитель — $Na_2CO_3$ (за счет $Na^{+1}$ и $C^{+4}$), восстановитель — $C$.
г) P + KOH + H₂O → KH₂PO₂ + PH₃
Решение:
Это реакция диспропорционирования. Определим степени окисления фосфора: $P^0 + K^{+1}O^{-2}H^{+1} + H_2O \rightarrow K^{+1}H^{+1}_2P^{+1}O^{-2}_2 + P^{-3}H^{+1}_3$.
Фосфор ($P^0$) одновременно окисляется до $P^{+1}$ и восстанавливается до $P^{-3}$. Следовательно, фосфор является и окислителем, и восстановителем.
Составим электронный баланс:
$P^0 - 1e^- \rightarrow P^{+1} \quad | \space 3$ (окисление)
$P^0 + 3e^- \rightarrow P^{-3} \quad | \space 1$ (восстановление)
Для баланса электронов необходимо, чтобы 3 атома фосфора окислились, а 1 восстановился. Всего в реакции участвует 4 атома фосфора. Ставим 4 перед $P$, 3 перед $KH_2PO_2$ и 1 перед $PH_3$.
$4P + KOH + H_2O \rightarrow 3KH_2PO_2 + PH_3$
Уравняем калий: справа 3 атома, ставим 3 перед $KOH$.
$4P + 3KOH + H_2O \rightarrow 3KH_2PO_2 + PH_3$
Уравняем кислород и водород, подбирая коэффициент для воды. Слева O: 3 (из $KOH$) + 1 (из $H_2O$) = 4. Справа O: $3 \times 2 = 6$. Чтобы уравнять кислород, нужно 3 молекулы $H_2O$.
$4P + 3KOH + 3H_2O \rightarrow 3KH_2PO_2 + PH_3$
Проверяем водород: слева $3 + 3 \times 2 = 9$. Справа $3 \times 2 + 3 = 9$. Баланс достигнут.
Ответ: $4P + 3KOH + 3H_2O \rightarrow 3KH_2PO_2 + PH_3$. Окислитель и восстановитель — $P$.
д) S + Ba(OH)₂ → BaS + BaSO₃ + H₂O
Решение:
Это реакция диспропорционирования. Определим степени окисления серы: $S^0 \rightarrow S^{-2}$ (в $BaS$) и $S^{+4}$ (в $BaSO_3$).
Сера ($S^0$) является и окислителем (восстанавливаясь до $S^{-2}$), и восстановителем (окисляясь до $S^{+4}$).
Составим электронный баланс:
$S^0 - 4e^- \rightarrow S^{+4} \quad | \space 1$ (окисление)
$S^0 + 2e^- \rightarrow S^{-2} \quad | \space 2$ (восстановление)
На 1 окисленный атом серы приходится 2 восстановленных. Всего в реакции участвует 3 атома серы. Ставим 3 перед $S$, 2 перед $BaS$ и 1 перед $BaSO_3$.
$3S + Ba(OH)_2 \rightarrow 2BaS + BaSO_3 + H_2O$
Уравняем барий: справа $2+1=3$ атома, ставим 3 перед $Ba(OH)_2$.
$3S + 3Ba(OH)_2 \rightarrow 2BaS + BaSO_3 + H_2O$
Уравняем водород и кислород. Слева H: $3 \times 2 = 6$; O: $3 \times 2 = 6$. Справа нужно 3 молекулы $H_2O$, чтобы получить 6 H и $3+3=6$ O.
$3S + 3Ba(OH)_2 \rightarrow 2BaS + BaSO_3 + 3H_2O$
Ответ: $3S + 3Ba(OH)_2 \rightarrow 2BaS + BaSO_3 + 3H_2O$. Окислитель и восстановитель — $S$.
е) Cl₂ + NaOH → NaCl + NaClO + H₂O
Решение:
Это реакция диспропорционирования. Определим степени окисления хлора: $Cl_2^0 \rightarrow Cl^{-1}$ (в $NaCl$) и $Cl^{+1}$ (в $NaClO$).
Хлор ($Cl_2$) является и окислителем, и восстановителем.
Составим электронный баланс, учитывая, что хлор — двухатомная молекула:
$Cl_2^0 - 2e^- \rightarrow 2Cl^{+1}$ (окисление)
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ (восстановление)
Число отданных и принятых электронов равно, поэтому соотношение продуктов $NaCl$ и $NaClO$ должно быть 1:1 (или 2:2, то есть равное).
$Cl_2 + NaOH \rightarrow NaCl + NaClO + H_2O$
Уравняем натрий: справа 2 атома ($1+1$), ставим 2 перед $NaOH$.
$Cl_2 + 2NaOH \rightarrow NaCl + NaClO + H_2O$
Проверим остальные атомы. Cl: 2 = 1+1=2. Na: 2 = 1+1=2. H: 2 = 2. O: 2 = 1+1=2. Уравнение сбалансировано.
Ответ: $Cl_2 + 2NaOH \rightarrow NaCl + NaClO + H_2O$. Окислитель и восстановитель — $Cl_2$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 761 расположенного на странице 127 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №761 (с. 127), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














