Номер 5, страница 181 - гдз по химии 11 класс учебник Мычко, Прохоревич

Авторы: Мычко Д. И., Прохоревич К. Н., Борушко И. И.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2021 - 2025
Цвет обложки: зелёный с колбами
ISBN: 978-985-599-297-5
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава VI. Неметаллы. Параграф 32. Элементы VIA-группы. Кислород и сера - номер 5, страница 181.
№5 (с. 181)
Условия. №5 (с. 181)
скриншот условия
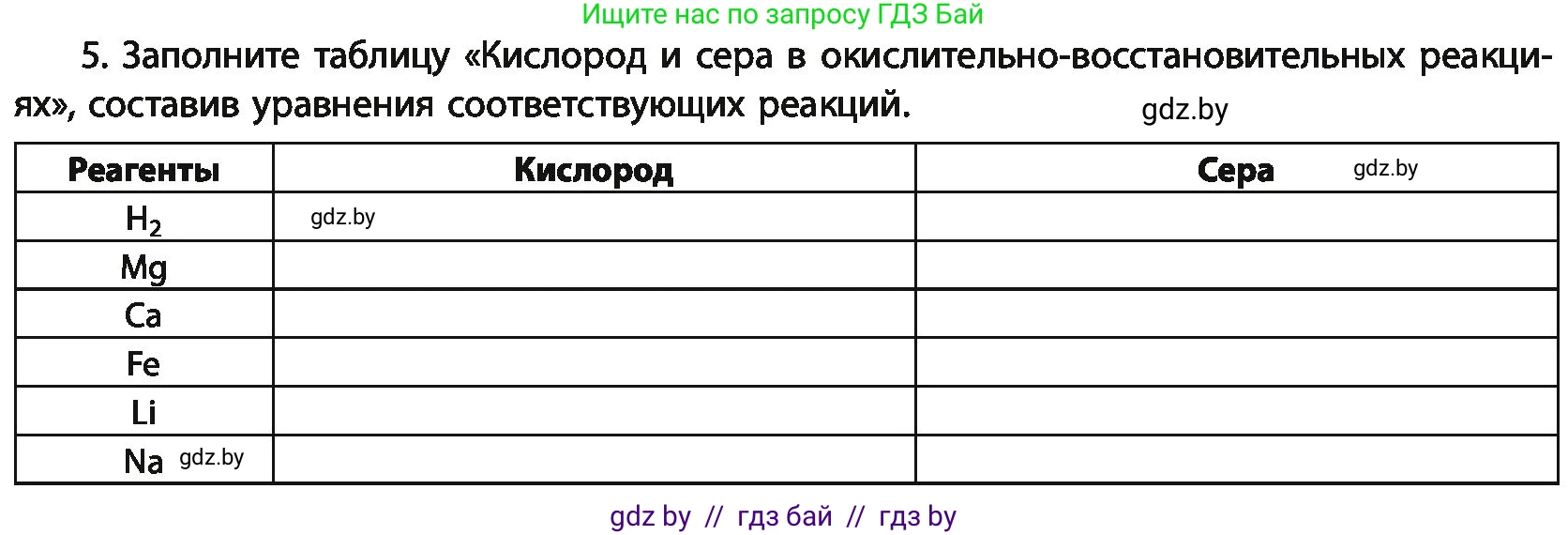
5. Заполните таблицу «Кислород и сера в окислительно-восстановительных реакциях», составив уравнения соответствующих реакций.
| Реагенты | Кислород | Сера |
| $H_2$ | ||
| $Mg$ | ||
| $Ca$ | ||
| $Fe$ | ||
| $Li$ | ||
| $Na$ |
Решение. №5 (с. 181)

Решение 2. №5 (с. 181)
| Реагенты | Кислород | Сера |
|---|---|---|
| $H_2$ | При взаимодействии водорода с кислородом (горение) образуется вода. В этой окислительно-восстановительной реакции кислород является окислителем, а водород — восстановителем. Уравнение реакции: $2H_2 + O_2 \rightarrow 2H_2O$. Процессы окисления-восстановления: $2H^0 - 2 \cdot 1e^- \rightarrow 2H^{+1}$ | окисление $O_2^0 + 4e^- \rightarrow 2O^{-2}$ | восстановление Ответ: вода ($H_2O$). | При нагревании водород реагирует с серой с образованием сероводорода. Сера выступает в роли окислителя, а водород — восстановителя. Уравнение реакции: $H_2 + S \xrightarrow{t} H_2S$. Процессы окисления-восстановления: $H_2^0 - 2e^- \rightarrow 2H^{+1}$ | окисление $S^0 + 2e^- \rightarrow S^{-2}$ | восстановление Ответ: сероводород ($H_2S$). |
| Mg | Магний активно горит в кислороде, образуя оксид магния. Кислород — окислитель, магний — восстановитель. Уравнение реакции: $2Mg + O_2 \rightarrow 2MgO$. Процессы окисления-восстановления: $Mg^0 - 2e^- \rightarrow Mg^{+2}$ | окисление $O_2^0 + 4e^- \rightarrow 2O^{-2}$ | восстановление Ответ: оксид магния ($MgO$). | При нагревании магний реагирует с серой с образованием сульфида магния. Сера — окислитель, магний — восстановитель. Уравнение реакции: $Mg + S \xrightarrow{t} MgS$. Процессы окисления-восстановления: $Mg^0 - 2e^- \rightarrow Mg^{+2}$ | окисление $S^0 + 2e^- \rightarrow S^{-2}$ | восстановление Ответ: сульфид магния ($MgS$). |
| Ca | Кальций горит в кислороде при нагревании, образуя оксид кальция. Кислород — окислитель, кальций — восстановитель. Уравнение реакции: $2Ca + O_2 \xrightarrow{t} 2CaO$. Процессы окисления-восстановления: $Ca^0 - 2e^- \rightarrow Ca^{+2}$ | окисление $O_2^0 + 4e^- \rightarrow 2O^{-2}$ | восстановление Ответ: оксид кальция ($CaO$). | При нагревании кальций реагирует с серой с образованием сульфида кальция. Сера — окислитель, кальций — восстановитель. Уравнение реакции: $Ca + S \xrightarrow{t} CaS$. Процессы окисления-восстановления: $Ca^0 - 2e^- \rightarrow Ca^{+2}$ | окисление $S^0 + 2e^- \rightarrow S^{-2}$ | восстановление Ответ: сульфид кальция ($CaS$). |
| Fe | При сгорании железа в кислороде образуется железная окалина — смешанный оксид железа(II, III). Кислород — окислитель, железо — восстановитель. Уравнение реакции: $3Fe + 2O_2 \xrightarrow{t} Fe_3O_4$. Процессы окисления-восстановления: $3Fe^0 - 8e^- \rightarrow Fe^{+2}Fe_2^{+3}$ | окисление $2O_2^0 + 8e^- \rightarrow 4O^{-2}$ | восстановление Ответ: железная окалина (оксид железа(II, III), $Fe_3O_4$). | При сплавлении железа с серой образуется сульфид железа(II). Сера — окислитель, железо — восстановитель. Уравнение реакции: $Fe + S \xrightarrow{t} FeS$. Процессы окисления-восстановления: $Fe^0 - 2e^- \rightarrow Fe^{+2}$ | окисление $S^0 + 2e^- \rightarrow S^{-2}$ | восстановление Ответ: сульфид железа(II) ($FeS$). |
| Li | Литий при сгорании в кислороде образует оксид лития. Кислород — окислитель, литий — восстановитель. Уравнение реакции: $4Li + O_2 \rightarrow 2Li_2O$. Процессы окисления-восстановления: $Li^0 - 1e^- \rightarrow Li^{+1}$ | окисление $O_2^0 + 4e^- \rightarrow 2O^{-2}$ | восстановление Ответ: оксид лития ($Li_2O$). | При нагревании литий реагирует с серой с образованием сульфида лития. Сера — окислитель, литий — восстановитель. Уравнение реакции: $2Li + S \xrightarrow{t} Li_2S$. Процессы окисления-восстановления: $Li^0 - 1e^- \rightarrow Li^{+1}$ | окисление $S^0 + 2e^- \rightarrow S^{-2}$ | восстановление Ответ: сульфид лития ($Li_2S$). |
| Na | Натрий при сгорании в кислороде образует преимущественно пероксид натрия. Кислород — окислитель, натрий — восстановитель. Уравнение реакции: $2Na + O_2 \xrightarrow{t} Na_2O_2$. Процессы окисления-восстановления: $Na^0 - 1e^- \rightarrow Na^{+1}$ | окисление $O_2^0 + 2e^- \rightarrow O_2^{-2}$ | восстановление Ответ: пероксид натрия ($Na_2O_2$). | При нагревании натрий бурно реагирует с серой с образованием сульфида натрия. Сера — окислитель, натрий — восстановитель. Уравнение реакции: $2Na + S \xrightarrow{t} Na_2S$. Процессы окисления-восстановления: $Na^0 - 1e^- \rightarrow Na^{+1}$ | окисление $S^0 + 2e^- \rightarrow S^{-2}$ | восстановление Ответ: сульфид натрия ($Na_2S$). |
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 5 расположенного на странице 181 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 181), авторов: Мычко (Дмитрий Иванович), Прохоревич (Константин Николаевич), Борушко (Ирина Ивановна), учебного пособия издательства Адукацыя i выхаванне.













