Номер 8, страница 212 - гдз по химии 11 класс учебник Мычко, Прохоревич

Авторы: Мычко Д. И., Прохоревич К. Н., Борушко И. И.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2021 - 2025
Цвет обложки: зелёный с колбами
ISBN: 978-985-599-297-5
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава VI. Неметаллы. Параграф 38. Азотная кислота - номер 8, страница 212.
№8 (с. 212)
Условия. №8 (с. 212)
скриншот условия

8. Методом электронного баланса расставьте коэффициенты в уравнениях реакций с участием азотной кислоты:
$S + HNO_{3(\text{конц})} = H_2SO_4 + NO_2\uparrow + H_2O$
$Mg + HNO_{3(\text{конц})} = Mg(NO_3)_2 + N_2 + H_2O$
Решение. №8 (с. 212)
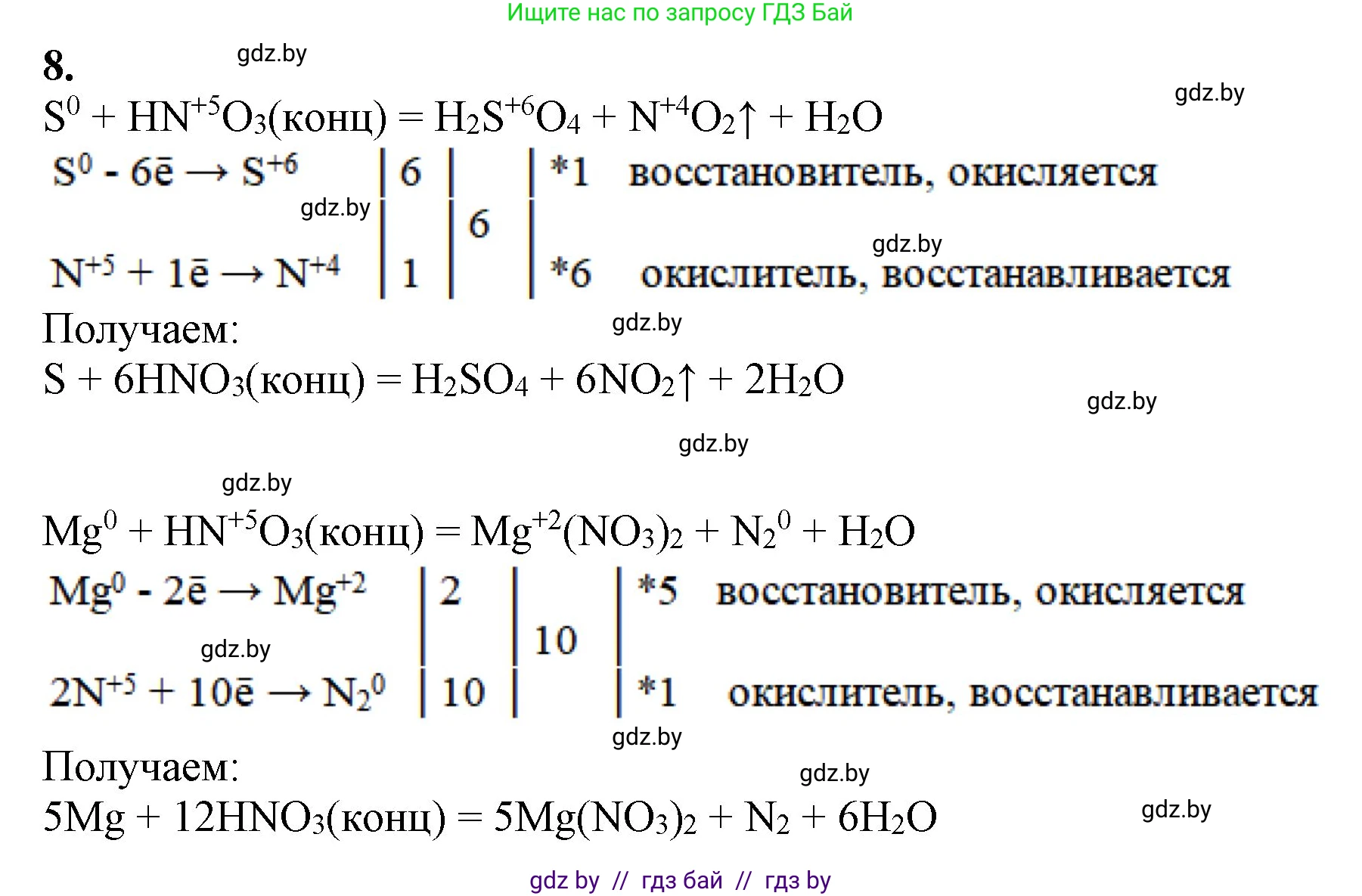
Решение 2. №8 (с. 212)
S + HNO₃(конц) = H₂SO₄ + NO₂↑ + H₂O
Решение:
1. Определим степени окисления элементов в каждом веществе. Степень окисления простого вещества равна нулю. В соединениях степень окисления кислорода, как правило, -2, водорода +1.
$S^0 + H^{+1}N^{+5}O^{-2}_3 = H^{+1}_2S^{+6}O^{-2}_4 + N^{+4}O^{-2}_2 + H^{+1}_2O^{-2}$
2. Выпишем элементы, которые изменили свою степень окисления. Это сера (S) и азот (N).
3. Составим уравнения полуреакций окисления и восстановления. Сера отдает электроны (окисляется), азот принимает электроны (восстанавливается).
Процесс окисления (сера - восстановитель):
$S^0 - 6e^- \rightarrow S^{+6}$
Процесс восстановления (азот в составе азотной кислоты - окислитель):
$N^{+5} + 1e^- \rightarrow N^{+4}$
4. Найдем наименьшее общее кратное (НОК) для числа отданных и принятых электронов. НОК(6, 1) = 6. Это означает, что в реакции участвует 1 атом серы и 6 атомов азота, изменяющих степень окисления.
$S^0 - 6e^- \rightarrow S^{+6}$ | 1
$N^{+5} + 1e^- \rightarrow N^{+4}$ | 6
5. Расставим коэффициенты в основном уравнении. Коэффициент 1 (обычно не пишется) ставим перед S и H₂SO₄. Коэффициент 6 ставим перед HNO₃ и NO₂.
$S + 6HNO_3 = H_2SO_4 + 6NO_2 + H_2O$
6. Уравняем число атомов водорода. В левой части 6 атомов H (в 6HNO₃). В правой части 2 атома H (в H₂SO₄), значит, для баланса не хватает 4 атомов водорода. Ставим коэффициент 2 перед H₂O ($2 \cdot 2 = 4$ атома H).
$S + 6HNO_3 = H_2SO_4 + 6NO_2 + 2H_2O$
7. Проверяем баланс атомов кислорода. Слева: $6 \cdot 3 = 18$. Справа: $4 + (6 \cdot 2) + 2 = 4 + 12 + 2 = 18$. Баланс верен.
Ответ: $S + 6HNO_3 = H_2SO_4 + 6NO_2 + 2H_2O$.
Mg + HNO₃(конц) = Mg(NO₃)₂ + N₂ + H₂O
Решение:
1. Определим степени окисления элементов:
$Mg^0 + H^{+1}N^{+5}O^{-2}_3 = Mg^{+2}(N^{+5}O^{-2}_3)_2 + N^0_2 + H^{+1}_2O^{-2}$
2. Элементы, изменившие свою степень окисления, - это магний (Mg) и азот (N). Часть атомов азота из азотной кислоты восстанавливается до $N_2$, а другая часть остается в степени окисления +5, переходя в состав соли Mg(NO₃)₂.
3. Составим полуреакции:
Процесс окисления (магний - восстановитель):
$Mg^0 - 2e^- \rightarrow Mg^{+2}$
Процесс восстановления (азот - окислитель). Учитываем, что молекула азота $N_2$ состоит из двух атомов:
$2N^{+5} + 10e^- \rightarrow N_2^0$
4. Уравняем число электронов. НОК(2, 10) = 10. Домножим первую полуреакцию на 5, а вторую на 1.
$Mg^0 - 2e^- \rightarrow Mg^{+2}$ | 5
$2N^{+5} + 10e^- \rightarrow N_2^0$ | 1
5. Расставим коэффициенты. Перед Mg и Mg(NO₃)₂ ставим коэффициент 5. Перед N₂ ставим коэффициент 1 (не пишется).
$5Mg + HNO_3 = 5Mg(NO_3)_2 + N_2 + H_2O$
6. Уравняем общее число атомов азота. В правой части $5 \cdot 2 = 10$ атомов N в нитрате магния и 2 атома N в молекуле N₂. Всего $10 + 2 = 12$ атомов N. Следовательно, в левой части перед HNO₃ нужно поставить коэффициент 12.
$5Mg + 12HNO_3 = 5Mg(NO_3)_2 + N_2 + H_2O$
7. Уравняем атомы водорода. Слева 12 атомов H (в 12HNO₃). Чтобы справа было 12 атомов H, ставим коэффициент 6 перед H₂O ($6 \cdot 2 = 12$).
$5Mg + 12HNO_3 = 5Mg(NO_3)_2 + N_2 + 6H_2O$
8. Проверяем баланс по кислороду. Слева: $12 \cdot 3 = 36$. Справа: $(5 \cdot 2 \cdot 3) + 6 = 30 + 6 = 36$. Баланс верен.
Ответ: $5Mg + 12HNO_3 = 5Mg(NO_3)_2 + N_2 + 6H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 8 расположенного на странице 212 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8 (с. 212), авторов: Мычко (Дмитрий Иванович), Прохоревич (Константин Николаевич), Борушко (Ирина Ивановна), учебного пособия издательства Адукацыя i выхаванне.













