лабораторный опыт 4, страница 9, часть 2 - гдз по химии 8 класс тетрадь для практических работ Борушко
Авторы: Борушко И. И.
Тип: Тетрадь для практических работ
Издательство: Сэр-Вит
Год издания: 2022 - 2025
Часть: 2
Цвет обложки: розовый с пробирками
ISBN: 978-985-597-607-4
Рекомендовано Научно-методическим учреждением «Национальный институт образования» Министерства образования Республики Беларусь
Популярные ГДЗ в 8 классе
Часть 2. Лабораторные опыты. Составление моделей молекул с ковалентным типом связи - страница 9.
лабораторный опыт 4 (с. 9)
Условие. лабораторный опыт 4 (с. 9)
скриншот условия


Лабораторный опыт 4. 20 г.
Составление моделей молекул
Цель: усовершенствовать представление о пространственном строении некоторых молекул, их сравнительных размерах.
Оборудование: шарики — модели атомов:
— белые шарики — модели атомов водорода (5 шт.);
— красные шарики — модели атомов кислорода (3 шт.);
— зеленые шарики — модели атомов хлора (1 шт.).
— Стержни различной длины.
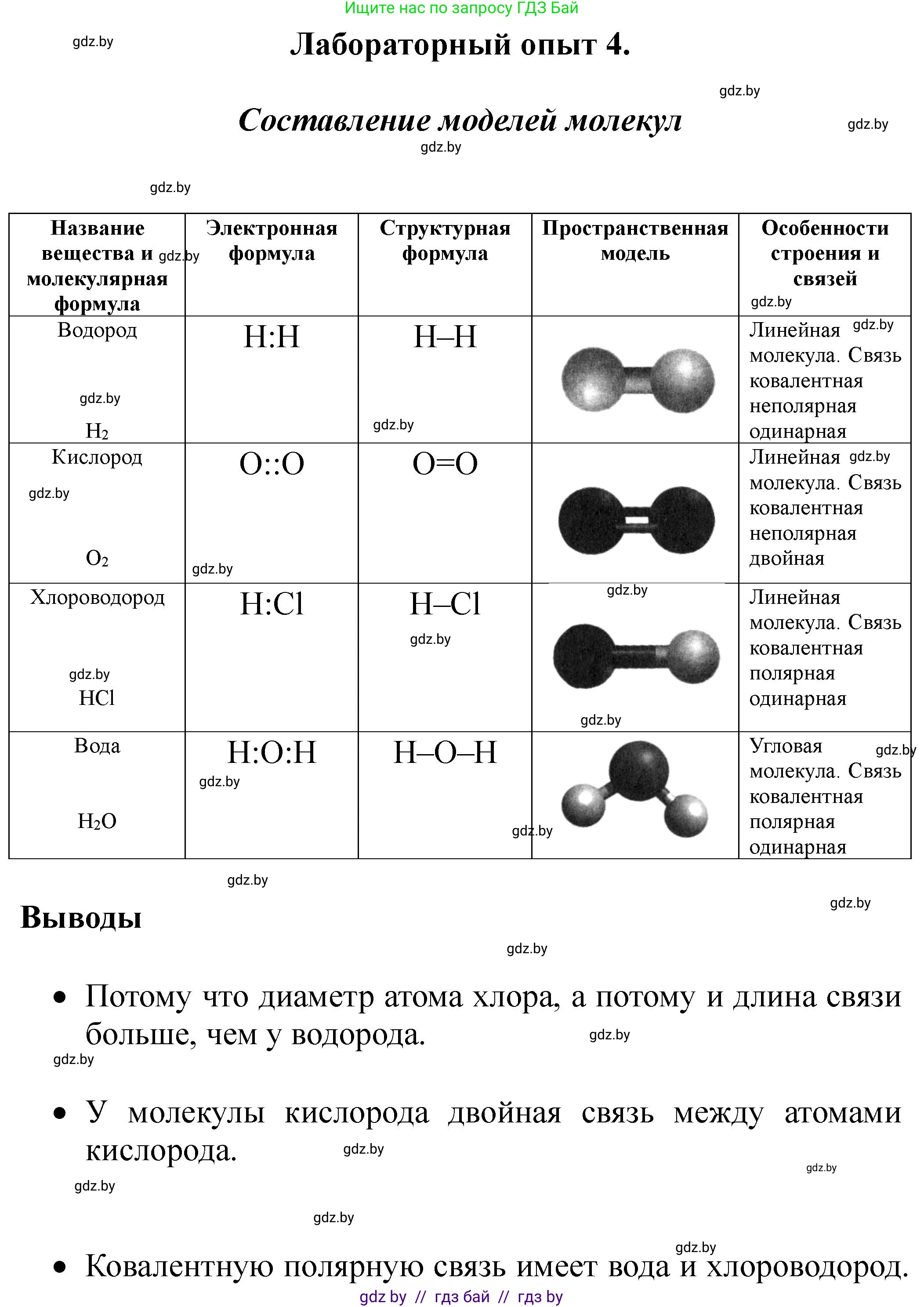
Используя электронные и структурные формулы молекул, а также сведения о пространственном строении молекул, изготовьте модели молекул водорода, кислорода, хлороводорода, воды. Заполните таблицу.
Название вещества и молекулярная формула
Электронная формула
Структурная формула
Пространственная модель
Особенности строения и связей
Водород
$H_2$
H : H
H - H
Линейная молекула. Связь ковалентная неполярная одинарная
Кислород
Хлороводород
Вода
Угловая форма, угол $105^\circ$
Две одинарные ковалентные полярные связи
Ответьте на вопросы.
• Почему для изготовления модели молекулы хлороводорода необходимо использовать более длинные стержни, чем для модели молекулы водорода?
• Какими особенностями строения отличается молекула кислорода от молекул водорода и хлороводорода?
• Какие из представленных моделями молекул имеют ковалентную полярную связь?
Выводы
Задание
Учениками были собраны модели следующих молекул:
HF
HBr
По рисункам моделей сравните длину связей в данной паре веществ. Дайте объяснение с точки зрения изменения радиусов атомов в периодах и группах периодической системы элементов.
Решение. лабораторный опыт 4 (с. 9)

Решение 2. лабораторный опыт 4 (с. 9)
Используя электронные и структурные формулы молекул, а также сведения о пространственном строении молекул, изготовили модели молекул водорода, кислорода, хлороводорода, воды. Заполним таблицу.
| Название вещества и молекулярная формула | Электронная формула | Структурная формула | Пространственная модель | Особенности строения и связей |
|---|---|---|---|---|
| Водород H₂ | H : H | H-H | изображение модели: два белых шарика, соединенных коротким стержнем | Линейная молекула. Связь ковалентная неполярная одинарная |
| Кислород O₂ | $:O::O:$ | O=O | изображение модели: два красных шарика, соединенных двумя стержнями | Линейная молекула. Связь ковалентная неполярная двойная |
| Хлороводород HCl | H:Cl: | H-Cl | изображение модели: один белый шарик и один зеленый шарик, соединенные одним стержнем | Линейная молекула. Связь ковалентная полярная одинарная |
| Вода H₂O | H:O:H | H-O-H | изображение модели: один красный шарик, соединенный с двумя белыми шариками под углом | Угловая форма, угол 105°. Две одинарные ковалентные полярные связи |
Ответьте на вопросы.
Почему для изготовления молекулы хлороводорода необходимо использовать более длинные стержни, чем для модели молекулы водорода?
Ответ: Для изготовления модели молекулы хлороводорода (HCl) необходимо использовать более длинные стержни, чем для модели молекулы водорода (H₂), потому что атом хлора (Cl) значительно больше атома водорода (H). Длина ковалентной связи зависит от радиусов связанных атомов. Поскольку радиус атома Cl больше радиуса атома H, расстояние между ядрами в молекуле HCl будет больше, чем в молекуле H₂, состоящей из двух маленьких атомов водорода. Следовательно, для адекватного представления этой большей длины связи требуется более длинный стержень.
Какими особенностями строения отличается молекула кислорода от молекул водорода и хлороводорода?
Ответ: Молекула кислорода (O₂) отличается от молекул водорода (H₂) и хлороводорода (HCl) типом ковалентной связи. В молекуле кислорода между двумя атомами кислорода образуется двойная ковалентная связь ($O=O$), тогда как в молекулах водорода ($H-H$) и хлороводорода ($H-Cl$) образуются одинарные ковалентные связи.
Какие из представленных моделей молекул имеют ковалентную полярную связь?
Ответ: Ковалентную полярную связь имеют молекулы, образованные атомами с различной электроотрицательностью. Из представленных моделей такие связи содержат молекулы хлороводорода (HCl), так как хлор более электроотрицателен, чем водород, и воды (H₂O), так как кислород более электроотрицателен, чем водород. Молекулы водорода (H₂) и кислорода (O₂) содержат неполярные ковалентные связи, поскольку образованы атомами одного и того же элемента (разница электроотрицательностей равна нулю).
Выводы
Ответ: * Использование моделей молекул позволяет наглядно представить пространственное строение веществ, их форму и углы между связями. * Длина ковалентной связи зависит от размеров связанных атомов; чем больше радиус атомов, тем длиннее связь. * Тип химической связи (одинарная, двойная) определяет расстояние между атомами и энергию связи. * Разница в электроотрицательности между атомами определяет полярность ковалентной связи и, как следствие, полярность молекулы.
Задание
По рисункам моделей сравните длину связей в данной паре веществ. Дайте объяснение с точки зрения изменения радиусов атомов в периодах и группах периодической системы элементов.
Дано
Молекулы: HF и HBr
Найти:
Сравнить длины связей $HF$ и $HBr$
Решение
Длина ковалентной связи в молекуле зависит от размеров (радиусов) связанных атомов. Чем больше радиус атома, тем длиннее будет связь, которую он образует с другим атомом (при прочих равных условиях).
Рассмотрим атомы, образующие связи с водородом в молекулах $HF$ и $HBr$: это фтор ($F$) и бром ($Br$).
Фтор ($F$) находится во втором периоде, семнадцатой группе периодической системы.
Бром ($Br$) находится в четвёртом периоде, семнадцатой группе периодической системы.
В одной группе периодической системы элементов атомный радиус увеличивается сверху вниз, так как возрастает число электронных слоев. Следовательно, радиус атома брома ($Br$) значительно больше радиуса атома фтора ($F$).
Поскольку атом водорода ($H$) является общим для обеих молекул, длина связи будет определяться размером второго атома. Так как атом брома больше атома фтора, связь $H-Br$ будет длиннее, чем связь $H-F$.
Ответ: Длина связи $H-Br$ больше, чем длина связи $H-F$. Это объясняется тем, что атомный радиус брома ($Br$) больше атомного радиуса фтора ($F$), так как бром расположен ниже фтора в одной группе периодической системы элементов (в группе сверху вниз увеличивается число электронных слоев, что приводит к увеличению атомного радиуса). Чем больше радиус атома, тем длиннее связь, которую он образует.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения лабораторный опыт 4 расположенного на странице 9 для 2-й части к тетради для практических работ 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению лабораторный опыт 4 (с. 9), автора: Борушко (Ирина Ивановна), 2-й части учебного пособия издательства Сэр-Вит.














