лабораторный опыт 3, страница 6, часть 2 - гдз по химии 8 класс тетрадь для практических работ Борушко
Авторы: Борушко И. И.
Тип: Тетрадь для практических работ
Издательство: Сэр-Вит
Год издания: 2022 - 2025
Часть: 2
Цвет обложки: розовый с пробирками
ISBN: 978-985-597-607-4
Рекомендовано Научно-методическим учреждением «Национальный институт образования» Министерства образования Республики Беларусь
Популярные ГДЗ в 8 классе
Часть 2. Лабораторные опыты. Получение гидроксида алюминия и изучение его свойств - страница 6.
лабораторный опыт 3 (с. 6)
Условие. лабораторный опыт 3 (с. 6)
скриншот условия



Лабораторный опыт 3. « » 20 г.
Получeние гидроксида алюминия (цинка) и изучение его свойств
Цель: совершенствовать знания о способах получения нерастворимых оснований; подтвердить амфотерность гидроксида алюминия (цинка).
Реактивы: растворы соли алюминия ($AlCl_3$, $Al_2(SO_4)_3$ или $Al(NO_3)_3$), гидроксида натрия $NaOH$, хлороводородной кислоты $HCl$. Вместо солей алюминия могут быть соли цинка ($ZnCl_2$, $ZnSO_4$).
Оборудование: пробирки в штативе.
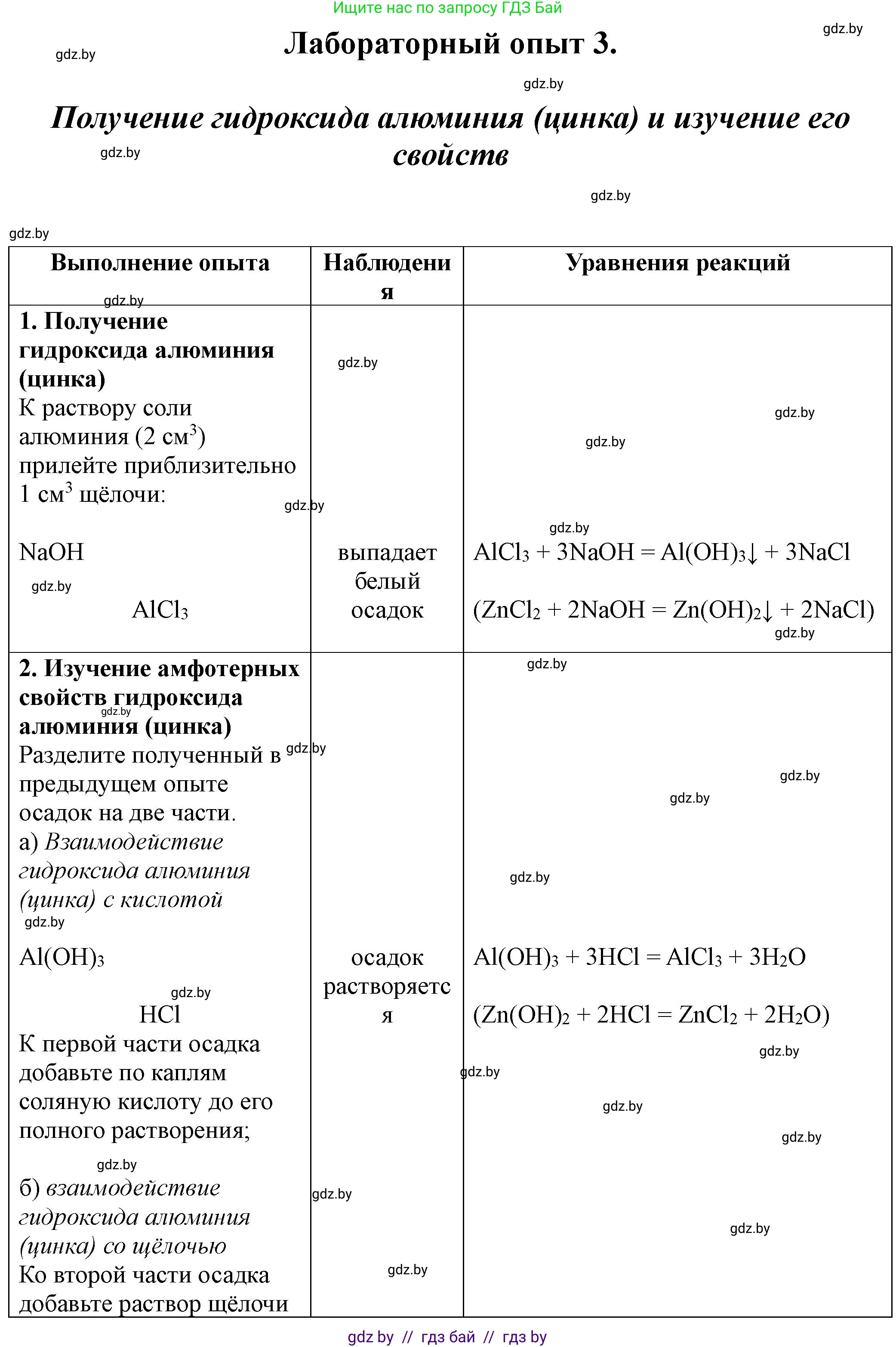
Выполнение опыта Наблюдения Уравнение реакции
1. Получение гидроксида алюминия (цинка)
К раствору соли алюминия ($2 \text{ см}^3$) прилейте приблизительно $1 \text{ см}^3$ щелочи
2. Изучение амфотерных свойств гидроксида алюминия (цинка)
Разделите полученный в предыдущем опыте осадок на две части.
a) Взаимодействие гидроксида алюминия (цинка) с кислотой
К первой части осадка добавьте по каплям соляную кислоту до его полного растворения;
б) взаимодействие гидроксида алюминия (цинка) со щелочью
Ко второй части осадка добавьте раствор щелочи до полного растворения осадка (образование растворимой соли)
В выводе дайте полные ответы на вопросы.
• Из веществ каких классов получают нерастворимые (в том числе амфотерные) основания?
• Почему гидроксид алюминия является амфотерным?
Вывод
Задания
1. Был получен гидроксид цинка и затем растворен в кислоте и щелочи. Опыт проводился по схеме:
$KOH \rightarrow Zn(NO_3)_2 \rightarrow Zn(OH)_2$
$HCl \rightarrow Zn(OH)_2$
$KOH \rightarrow Zn(OH)_2$
Составьте уравнения проведенных реакций. Сделайте вывод о свойствах гидроксида цинка.
2. Почему при получении амфотерного основания необходимо приливать щелочь к раствору соли, а не наоборот?
Решение. лабораторный опыт 3 (с. 6)


Решение 2. лабораторный опыт 3 (с. 6)
Получение гидроксида алюминия (цинка)
Наблюдения: При добавлении щелочи к раствору соли алюминия (например, хлорида алюминия) или соли цинка (например, хлорида цинка) образуется белый студенистый осадок.
Уравнение реакции:
$\text{AlCl}_3 + 3\text{NaOH} \rightarrow \text{Al(OH)}_3 \downarrow + 3\text{NaCl}$
или
$\text{ZnCl}_2 + 2\text{NaOH} \rightarrow \text{Zn(OH)}_2 \downarrow + 2\text{NaCl}$
Ответ: При добавлении щелочи к раствору соли образуется белый студенистый осадок нерастворимого гидроксида.
2. Изучение амфотерных свойств гидроксида алюминия (цинка)
а) Взаимодействие гидроксида алюминия (цинка) с кислотой
Наблюдения: При добавлении соляной кислоты к осадку гидроксида алюминия (или цинка) осадок постепенно растворяется, образуя прозрачный раствор.
Уравнение реакции:
$\text{Al(OH)}_3 + 3\text{HCl} \rightarrow \text{AlCl}_3 + 3\text{H}_2\text{O}$
или
$\text{Zn(OH)}_2 + 2\text{HCl} \rightarrow \text{ZnCl}_2 + 2\text{H}_2\text{O}$
Ответ: Гидроксид алюминия (цинка) реагирует с кислотой, подтверждая его основные свойства.
б) Взаимодействие гидроксида алюминия (цинка) со щелочью
Наблюдения: При добавлении раствора щелочи к осадку гидроксида алюминия (или цинка) осадок постепенно растворяется, образуя прозрачный раствор.
Уравнение реакции:
$\text{Al(OH)}_3 + \text{NaOH} \rightarrow \text{Na}[\text{Al(OH)}_4]$
или
$\text{Zn(OH)}_2 + 2\text{NaOH} \rightarrow \text{Na}_2[\text{Zn(OH)}_4]$
Ответ: Гидроксид алюминия (цинка) реагирует со щелочью, подтверждая его кислотные свойства.
Вывод
Из веществ каких классов получают нерастворимые (в том числе амфотерные) основания?
Нерастворимые основания, включая амфотерные гидроксиды, получают из растворов солей соответствующих металлов путем взаимодействия с раствором щелочи (растворимым основанием). Эта реакция является реакцией обмена, в результате которой образуется нерастворимый гидроксид и новая соль.
Ответ: Нерастворимые основания получают из солей соответствующих металлов и растворимых оснований (щелочей).
Почему гидроксид алюминия является амфотерным?
Гидроксид алюминия ($\text{Al(OH)}_3$) является амфотерным, потому что он проявляет двойственные химические свойства: реагирует как с кислотами, проявляя свойства основания, так и с сильными щелочами, проявляя свойства кислоты. Это происходит из-за его способности диссоциировать как по типу основания ($\text{Al(OH)}_3 \rightleftharpoons \text{Al}^{3+} + 3\text{OH}^-$), так и по типу кислоты ($\text{Al(OH)}_3 \rightleftharpoons \text{H}^+ + [\text{AlO}_2\cdot\text{H}_2\text{O}]^-$ или $\text{H}^+ + \text{H}_2[\text{AlO}_3]^-$ или $\text{H}_2\text{O} + \text{H}[\text{Al(OH)}_4]^-$). В кислой среде преобладает основная диссоциация, в щелочной – кислотная.
Ответ: Гидроксид алюминия амфотерен, так как реагирует и с кислотами, и со щелочами.
Задания
1. Был получен гидроксид цинка и затем растворен в кислоте и щелочи. Опыт проводился по схеме:
Составьте уравнения проведенных реакций.
1) Получение гидроксида цинка:
$\text{Zn(NO}_3)_2 + 2\text{KOH} \rightarrow \text{Zn(OH)}_2 \downarrow + 2\text{KNO}_3$
2) Растворение гидроксида цинка в кислоте:
$\text{Zn(OH)}_2 + 2\text{HCl} \rightarrow \text{ZnCl}_2 + 2\text{H}_2\text{O}$
3) Растворение гидроксида цинка в щелочи:
$\text{Zn(OH)}_2 + 2\text{KOH} \rightarrow \text{K}_2[\text{Zn(OH)}_4]$
Сделайте вывод о свойствах гидроксида цинка.
Гидроксид цинка ($\text{Zn(OH)}_2$) является амфотерным гидроксидом. Это подтверждается его способностью реагировать как с кислотами, так и с сильными щелочами, в обоих случаях образуя растворимые соединения.
Ответ: Уравнения реакций представлены выше. Гидроксид цинка является амфотерным гидроксидом, проявляющим свойства как основания, так и кислоты.
2. Почему при получении амфотерного основания необходимо приливать щелочь к раствору соли, а не наоборот?
При получении амфотерного гидроксида (например, $\text{Al(OH)}_3$ или $\text{Zn(OH)}_2$) необходимо приливать раствор щелочи к раствору соли, а не наоборот, чтобы избежать растворения образующегося осадка в избытке щелочи. Амфотерные гидроксиды способны растворяться в сильных щелочах с образованием растворимых комплексных солей. Если приливать раствор соли к щелочи, или если щелочь будет в значительном избытке с самого начала, то образовавшийся осадок амфотерного гидроксида сразу же растворится, и осадок не будет наблюдаться или его будет очень мало. Постепенное добавление щелочи к соли позволяет контролировать реакцию и остановить добавление реагента, как только будет достигнуто максимальное образование осадка, предотвращая его дальнейшее растворение.
Пример реакции с избытком щелочи:
$\text{Al(OH)}_3 + \text{NaOH}_{\text{избыток}} \rightarrow \text{Na}[\text{Al(OH)}_4]$ (осадок растворяется)
Ответ: Чтобы предотвратить растворение образовавшегося амфотерного гидроксида в избытке щелочи, так как амфотерные гидроксиды растворяются в сильных щелочах, образуя комплексные соли.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения лабораторный опыт 3 расположенного на странице 6 для 2-й части к тетради для практических работ 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению лабораторный опыт 3 (с. 6), автора: Борушко (Ирина Ивановна), 2-й части учебного пособия издательства Сэр-Вит.














