Номер 4, страница 188 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 5. Химическая связь. Параграф 45. Ионная связь - номер 4, страница 188.
№4 (с. 188)
Условие. №4 (с. 188)
скриншот условия

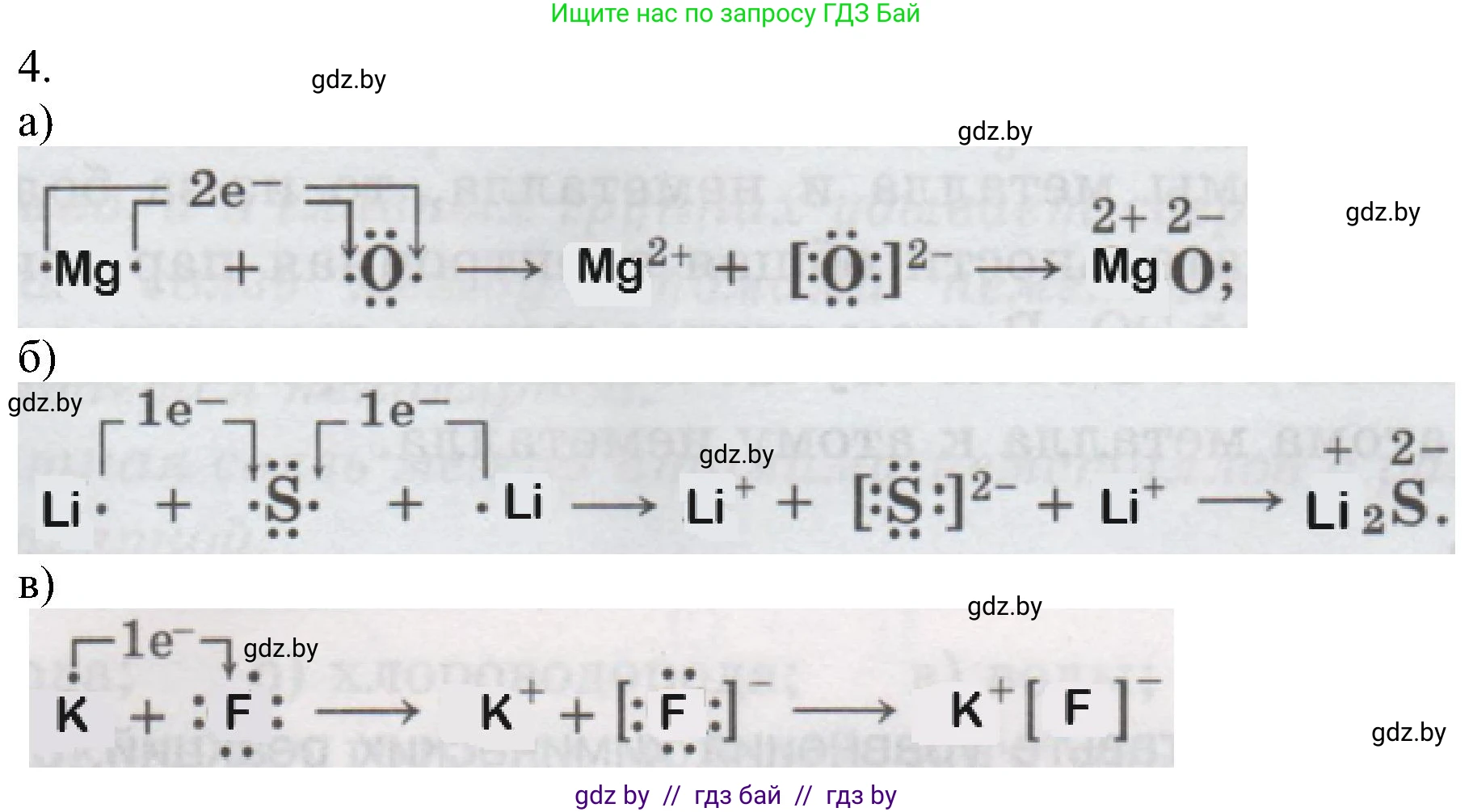
4. Изобразите схемы образования ионной связи при взаимодействии атомов:
а) Mg и O;
б) Li и S;
в) K и F.
Решение. №4 (с. 188)
Решение 2. №4 (с. 188)
Ионная связь образуется в результате электростатического притяжения между противоположно заряженными ионами (катионами и анионами). Ионы, в свою очередь, образуются из атомов в результате отдачи или присоединения электронов. Как правило, ионная связь возникает между атомами типичных металлов и типичных неметаллов.
а) Mg и O
1. Атом магния ($Mg$) — это атом металла, который находится во 2-й группе главной подгруппы, в 3-м периоде. Его порядковый номер 12, заряд ядра $+12$. Электронная конфигурация атома: $1s^2 2s^2 2p^6 3s^2$. На внешнем электронном слое находится 2 валентных электрона. Для достижения стабильной восьмиэлектронной оболочки (как у инертного газа неона) атому магния энергетически выгоднее отдать эти 2 электрона.
Процесс отдачи электронов можно записать так: $Mg^0 - 2e^- \rightarrow Mg^{2+}$
В результате атом магния превращается в положительно заряженный ион (катион) магния с зарядом $2+$.
2. Атом кислорода ($O$) — это атом неметалла, который находится в 16-й группе главной подгруппы, во 2-м периоде. Его порядковый номер 8, заряд ядра $+8$. Электронная конфигурация атома: $1s^2 2s^2 2p^4$. На внешнем электронном слое находится 6 валентных электронов. Для завершения внешнего слоя до стабильного октета (8 электронов) атому кислорода необходимо принять 2 электрона.
Процесс принятия электронов: $O^0 + 2e^- \rightarrow O^{2-}$
В результате атом кислорода превращается в отрицательно заряженный ион (анион) кислорода с зарядом $2-$.
3. Схема образования связи: Атом магния отдает два своих валентных электрона атому кислорода. Образуются ионы $Mg^{2+}$ и $O^{2-}$, которые за счет электростатических сил притягиваются друг к другу, формируя ионную связь и образуя соединение оксид магния ($MgO$).
Суммарная схема: $Mg + O \rightarrow Mg^{2+}O^{2-}$
Ответ: Схема образования ионной связи: атом магния отдает 2 электрона, превращаясь в катион $Mg^{2+}$ ($Mg - 2e^- \rightarrow Mg^{2+}$), а атом кислорода принимает эти 2 электрона, превращаясь в анион $O^{2-}$ ($O + 2e^- \rightarrow O^{2-}$). Возникает ионная связь между образовавшимися ионами, формируя соединение $MgO$.
б) Li и S
1. Атом лития ($Li$) — это атом щелочного металла, который находится в 1-й группе главной подгруппы, во 2-м периоде. Его порядковый номер 3, заряд ядра $+3$. Электронная конфигурация: $1s^2 2s^1$. На внешнем слое у лития 1 валентный электрон, который он легко отдает для достижения стабильной конфигурации (как у гелия).
Процесс отдачи электрона: $Li^0 - 1e^- \rightarrow Li^{+}$
В результате образуется катион лития с зарядом $1+$.
2. Атом серы ($S$) — это атом неметалла, который находится в 16-й группе главной подгруппы, в 3-м периоде. Его порядковый номер 16, заряд ядра $+16$. Электронная конфигурация: $1s^2 2s^2 2p^6 3s^2 3p^4$. На внешнем слое у серы 6 валентных электронов. Для завершения внешнего слоя до октета атому серы необходимо принять 2 электрона.
Процесс принятия электронов: $S^0 + 2e^- \rightarrow S^{2-}$
В результате образуется сульфид-анион с зарядом $2-$.
3. Схема образования связи: Атому серы для стабилизации нужно 2 электрона, а один атом лития может отдать только 1. Поэтому во взаимодействии участвуют два атома лития и один атом серы. Каждый атом лития отдает по одному электрону атому серы. В результате образуются два катиона лития $Li^{+}$ и один анион серы $S^{2-}$. Разноименно заряженные ионы притягиваются, образуя ионное соединение — сульфид лития ($Li_2S$).
Суммарная схема: $2Li + S \rightarrow (Li^{+})_2S^{2-}$
Ответ: Схема образования ионной связи: два атома лития отдают по одному электрону ($2Li - 2e^- \rightarrow 2Li^{+}$), а один атом серы принимает эти два электрона ($S + 2e^- \rightarrow S^{2-}$). Образуется ионное соединение $Li_2S$ за счет притяжения ионов $2Li^{+}$ и $S^{2-}$.
в) K и F
1. Атом калия ($K$) — это атом щелочного металла, который находится в 1-й группе главной подгруппы, в 4-м периоде. Его порядковый номер 19, заряд ядра $+19$. Электронная конфигурация: $1s^2 2s^2 2p^6 3s^2 3p^6 4s^1$. На внешнем слое у калия 1 валентный электрон, который он легко отдает для достижения стабильной конфигурации (как у аргона).
Процесс отдачи электрона: $K^0 - 1e^- \rightarrow K^{+}$
В результате образуется катион калия с зарядом $1+$.
2. Атом фтора ($F$) — это атом галогена (неметалл), который находится в 17-й группе главной подгруппы, во 2-м периоде. Его порядковый номер 9, заряд ядра $+9$. Электронная конфигурация: $1s^2 2s^2 2p^5$. На внешнем слое у фтора 7 валентных электронов. Для завершения внешнего слоя до октета ему не хватает одного электрона.
Процесс принятия электрона: $F^0 + 1e^- \rightarrow F^{-}$
В результате образуется фторид-анион с зарядом $1-$.
3. Схема образования связи: Атом калия отдает свой один валентный электрон атому фтора. В результате образуются катион калия $K^{+}$ и анион фтора $F^{-}$. Ионы притягиваются друг к другу, образуя ионное соединение — фторид калия ($KF$).
Суммарная схема: $K + F \rightarrow K^{+}F^{-}$
Ответ: Схема образования ионной связи: атом калия отдает 1 электрон, превращаясь в катион $K^{+}$ ($K - 1e^- \rightarrow K^{+}$), а атом фтора принимает этот электрон, превращаясь в анион $F^{-}$ ($F + 1e^- \rightarrow F^{-}$). Возникает ионная связь между образовавшимися ионами, формируя соединение $KF$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 4 расположенного на странице 188 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 188), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













