Номер 7, страница 185 - гдз по химии 8 класс учебник Шиманович, Красицкий

Авторы: Шиманович И. Е., Красицкий В. А., Сечко О. И., Хвалюк В. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2024 - 2025
Цвет обложки: синий, розовый с таблицей Менделеева
ISBN: 978-985-03-2941-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава 5. Химическая связь. Параграф 44. Неполярная и полярная ковалентная связь. Электроотрицательность - номер 7, страница 185.
№7 (с. 185)
Условие. №7 (с. 185)
скриншот условия

7. Структурная формула молекулы воды: $H-O-H$. Составьте электронную формулу молекулы этого вещества. Укажите над каждым символом знак частичного заряда атома.
Решение. №7 (с. 185)
Решение 2. №7 (с. 185)
Решение
Чтобы составить электронную формулу и указать частичные заряды для молекулы воды ($H_2O$), необходимо проанализировать ее строение и свойства атомов, входящих в ее состав.
1. Составление электронной формулы (формулы Льюиса).
Сначала определим количество валентных (внешних) электронов для каждого атома:
- Атом водорода ($H$) находится в 1-й группе периодической системы, у него 1 валентный электрон.
- Атом кислорода ($O$) находится в 16-й группе, у него 6 валентных электронов.
В молекуле воды ($H_2O$) атом кислорода является центральным. Он образует две одинарные ковалентные связи с двумя атомами водорода. Каждая связь представляет собой общую электронную пару, состоящую из одного электрона от кислорода и одного электрона от водорода.
Таким образом, на образование двух связей атом кислорода тратит 2 из своих 6 валентных электронов. Оставшиеся 4 электрона ($6 - 2 = 4$) образуют две неподеленные электронные пары, которые принадлежат только атому кислорода.
Электронная формула, показывающая все валентные электроны в виде точек, выглядит следующим образом (двоеточия между атомами обозначают общие электронные пары, а точки у кислорода — неподеленные пары):
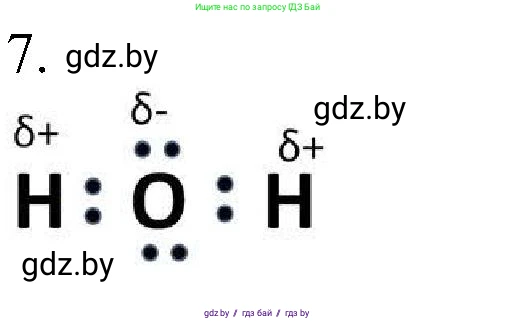
$ H:\underset{\Large\cdot\cdot}{\overset{\Large\cdot\cdot}{O}}:H $
2. Определение частичных зарядов.
Связь между кислородом и водородом является ковалентной полярной. Это связано с разной электроотрицательностью (ЭО) атомов. Электроотрицательность — это способность атома притягивать к себе электроны химической связи.
ЭО кислорода (≈3,44 по Полингу) значительно выше, чем ЭО водорода (≈2,20).
Из-за этого общие электронные пары в связях $O–H$ смещаются в сторону более электроотрицательного атома кислорода. В результате на атоме кислорода накапливается избыточный отрицательный заряд, который называется частичным отрицательным зарядом (${\delta-}$). Поскольку атом кислорода связан с двумя атомами водорода, его суммарный заряд часто обозначают как $2{\delta-}$.
На атомах водорода, наоборот, возникает недостаток электронной плотности, и они приобретают частичный положительный заряд (${\delta+}$).
Объединив электронную формулу и частичные заряды, получаем итоговый вид:
$ \overset{\delta+}{H}:\overset{2\delta-}{\underset{\Large\cdot\cdot}{\overset{\Large\cdot\cdot}{O}}}:\overset{\delta+}{H} $
Ответ: Электронная формула молекулы воды с указанием знаков частичного заряда на каждом атоме: $ \overset{\delta+}{H}:\overset{2\delta-}{\underset{\Large\cdot\cdot}{\overset{\Large\cdot\cdot}{O}}}:\overset{\delta+}{H} $
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7 расположенного на странице 185 к учебнику 2024 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 185), авторов: Шиманович (Игорь Евгеньевич), Красицкий (Василий Анатольевич), Сечко (Ольга Ивановна), Хвалюк (Виктор Николаевич), учебного пособия издательства Адукацыя i выхаванне.













