Номер 182, страница 43 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 2. Электролитическая диссоциация. Параграф 12. Реакции ионного обмена - номер 182, страница 43.
№182 (с. 43)
Условие. №182 (с. 43)
скриншот условия

182. Составьте молекулярные и ионные уравнения реакций, протекающих в водном растворе между:
а) $H_2CO_3$ и $NaOH$;
б) $Ca(NO_3)_2$ и $K_2CO_3$;
в) $FeCl_3$ и $Ca(OH)_2$;
г) $H_3PO_4$ и $Ca(OH)_2$;
д) $CuCl_2$ и $H_2S$;
е) $Ba(OH)_2$ и $CuSO_4$.
Решение. №182 (с. 43)

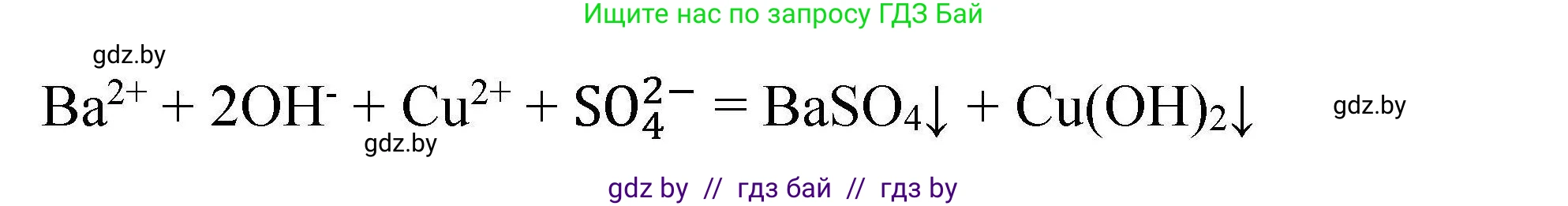
Решение 2. №182 (с. 43)
а) Реакция между угольной кислотой ($H_2CO_3$) и гидроксидом натрия ($NaOH$) является реакцией нейтрализации. Угольная кислота - слабая, гидроксид натрия - сильное основание (щелочь). В результате полной нейтрализации образуется растворимая соль карбонат натрия и вода.
Молекулярное уравнение:
$H_2CO_3 + 2NaOH \rightarrow Na_2CO_3 + 2H_2O$
Полное ионное уравнение (учитываем, что $H_2CO_3$ - слабый электролит и не диссоциирует полностью, а $NaOH$ и $Na_2CO_3$ - сильные электролиты):
$H_2CO_3 + 2Na^+ + 2OH^- \rightarrow 2Na^+ + CO_3^{2-} + 2H_2O$
Сокращенное ионное уравнение (после сокращения ионов $Na^+$):
$H_2CO_3 + 2OH^- \rightarrow CO_3^{2-} + 2H_2O$
Ответ: Молекулярное уравнение: $H_2CO_3 + 2NaOH \rightarrow Na_2CO_3 + 2H_2O$; сокращенное ионное уравнение: $H_2CO_3 + 2OH^- \rightarrow CO_3^{2-} + 2H_2O$.
б) Реакция между нитратом кальция ($Ca(NO_3)_2$) и карбонатом калия ($K_2CO_3$) - это реакция ионного обмена между двумя растворимыми солями. Реакция протекает, так как один из продуктов, карбонат кальция ($CaCO_3$), является нерастворимым веществом и выпадает в осадок.
Молекулярное уравнение:
$Ca(NO_3)_2 + K_2CO_3 \rightarrow CaCO_3\downarrow + 2KNO_3$
Полное ионное уравнение (все исходные соли и нитрат калия растворимы и диссоциируют):
$Ca^{2+} + 2NO_3^- + 2K^+ + CO_3^{2-} \rightarrow CaCO_3\downarrow + 2K^+ + 2NO_3^-$
Сокращенное ионное уравнение (после сокращения ионов-наблюдателей $K^+$ и $NO_3^-$):
$Ca^{2+} + CO_3^{2-} \rightarrow CaCO_3\downarrow$
Ответ: Молекулярное уравнение: $Ca(NO_3)_2 + K_2CO_3 \rightarrow CaCO_3\downarrow + 2KNO_3$; сокращенное ионное уравнение: $Ca^{2+} + CO_3^{2-} \rightarrow CaCO_3\downarrow$.
в) Реакция между хлоридом железа(III) ($FeCl_3$) и гидроксидом кальция ($Ca(OH)_2$) - это реакция ионного обмена между солью и основанием. Реакция идет до конца с образованием нерастворимого гидроксида железа(III) ($Fe(OH)_3$) в виде бурого осадка.
Молекулярное уравнение:
$2FeCl_3 + 3Ca(OH)_2 \rightarrow 2Fe(OH)_3\downarrow + 3CaCl_2$
Полное ионное уравнение (учитываем, что $FeCl_3$, $Ca(OH)_2$ и $CaCl_2$ - сильные электролиты):
$2Fe^{3+} + 6Cl^- + 3Ca^{2+} + 6OH^- \rightarrow 2Fe(OH)_3\downarrow + 3Ca^{2+} + 6Cl^-$
Сокращенное ионное уравнение (после сокращения ионов $Ca^{2+}$ и $Cl^-$ и деления коэффициентов на 2):
$Fe^{3+} + 3OH^- \rightarrow Fe(OH)_3\downarrow$
Ответ: Молекулярное уравнение: $2FeCl_3 + 3Ca(OH)_2 \rightarrow 2Fe(OH)_3\downarrow + 3CaCl_2$; сокращенное ионное уравнение: $Fe^{3+} + 3OH^- \rightarrow Fe(OH)_3\downarrow$.
г) Реакция между ортофосфорной кислотой ($H_3PO_4$) и гидроксидом кальция ($Ca(OH)_2$). Это реакция нейтрализации слабой кислоты сильным основанием, приводящая к образованию нерастворимой соли - фосфата кальция ($Ca_3(PO_4)_2$) - и воды.
Молекулярное уравнение:
$2H_3PO_4 + 3Ca(OH)_2 \rightarrow Ca_3(PO_4)_2\downarrow + 6H_2O$
Полное ионное уравнение (ортофосфорная кислота - слабый электролит, фосфат кальция - осадок, вода - слабый электролит):
$2H_3PO_4 + 3Ca^{2+} + 6OH^- \rightarrow Ca_3(PO_4)_2\downarrow + 6H_2O$
Сокращенное ионное уравнение в данном случае совпадает с полным, так как нет ионов-наблюдателей.
Ответ: Молекулярное уравнение: $2H_3PO_4 + 3Ca(OH)_2 \rightarrow Ca_3(PO_4)_2\downarrow + 6H_2O$; сокращенное ионное уравнение: $2H_3PO_4 + 3Ca^{2+} + 6OH^- \rightarrow Ca_3(PO_4)_2\downarrow + 6H_2O$.
д) Реакция между хлоридом меди(II) ($CuCl_2$) и сероводородной кислотой ($H_2S$). Это реакция обмена, протекающая благодаря образованию сульфида меди(II) ($CuS$) - очень нерастворимого соединения, которое выпадает в осадок даже из кислой среды.
Молекулярное уравнение:
$CuCl_2 + H_2S \rightarrow CuS\downarrow + 2HCl$
Полное ионное уравнение (сероводородная кислота - слабая, а соляная кислота - сильная):
$Cu^{2+} + 2Cl^- + H_2S \rightarrow CuS\downarrow + 2H^+ + 2Cl^-$
Сокращенное ионное уравнение (после сокращения ионов $Cl^-$):
$Cu^{2+} + H_2S \rightarrow CuS\downarrow + 2H^+$
Ответ: Молекулярное уравнение: $CuCl_2 + H_2S \rightarrow CuS\downarrow + 2HCl$; сокращенное ионное уравнение: $Cu^{2+} + H_2S \rightarrow CuS\downarrow + 2H^+$.
е) Реакция между гидроксидом бария ($Ba(OH)_2$) и сульфатом меди(II) ($CuSO_4$). В этой реакции ионного обмена оба продукта являются нерастворимыми веществами: сульфат бария ($BaSO_4$) и гидроксид меди(II) ($Cu(OH)_2$), поэтому оба выпадают в осадок.
Молекулярное уравнение:
$Ba(OH)_2 + CuSO_4 \rightarrow BaSO_4\downarrow + Cu(OH)_2\downarrow$
Полное ионное уравнение (исходные вещества - сильные электролиты, а продукты - нерастворимые соединения):
$Ba^{2+} + 2OH^- + Cu^{2+} + SO_4^{2-} \rightarrow BaSO_4\downarrow + Cu(OH)_2\downarrow$
Сокращенное ионное уравнение совпадает с полным, так как все ионы из исходных растворов связываются в осадки.
Ответ: Молекулярное уравнение: $Ba(OH)_2 + CuSO_4 \rightarrow BaSO_4\downarrow + Cu(OH)_2\downarrow$; сокращенное ионное уравнение: $Ba^{2+} + 2OH^- + Cu^{2+} + SO_4^{2-} \rightarrow BaSO_4\downarrow + Cu(OH)_2\downarrow$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 182 расположенного на странице 43 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №182 (с. 43), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














