Номер 335, страница 70 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 20. Оксид серы (IV) и оксид серы (VI) - номер 335, страница 70.
№335 (с. 70)
Условие. №335 (с. 70)
скриншот условия


335. Укажите продукты и составьте уравнения реакций:
a) $SO_2 + H_2O \to$;
б) $SO_2 + H_2S \to$;
в) $S + O_2 \to$;
г) $SO_2 + O_2 \to$;
д) $SO_2 + KOH \to$;
е) $SO_3 + H_2O \to$;
ё) $SO_3 + Ba(OH)_2 \to$;
ж) $SO_3 + Na_2O \to$.
Приведите уравнения соответствующих реакций в молекулярной и ионных формах. Укажите, какие из этих реакций являются окислительно-восстановительными.
Решение. №335 (с. 70)
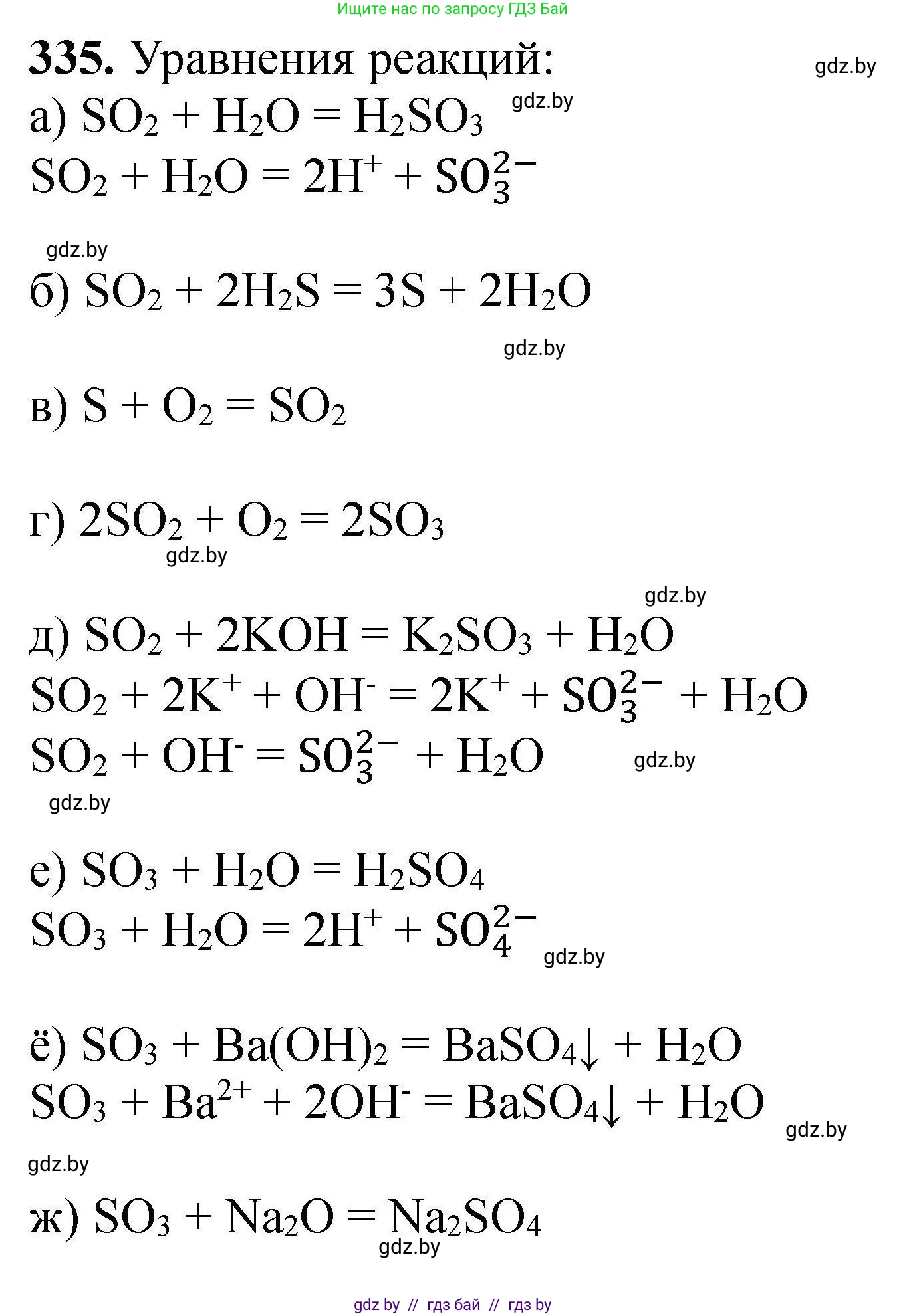
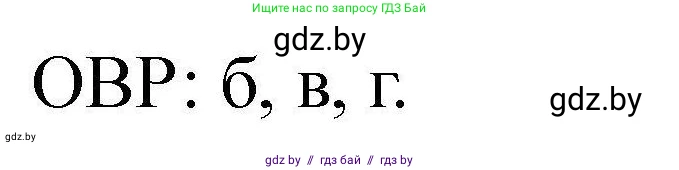
Решение 2. №335 (с. 70)
Решение
а) Оксид серы(IV) $SO_2$ является кислотным оксидом, который при взаимодействии с водой образует слабую сернистую кислоту $H_2SO_3$. Реакция обратима.
Молекулярное уравнение:
$SO_2 + H_2O \rightleftharpoons H_2SO_3$
Так как сернистая кислота является слабым электролитом, который в значительной степени существует в виде гидратированных молекул $SO_2$, ионные уравнения для этой реакции обычно не записывают. Степени окисления элементов не изменяются ($S^{+4}, O^{-2}, H^{+1}$), следовательно, реакция не является окислительно-восстановительной.
Ответ: Продукт реакции – сернистая кислота ($H_2SO_3$). Реакция не является окислительно-восстановительной.
б) Это реакция сопропорционирования, в которой сера из двух разных степеней окисления ($+4$ в $SO_2$ и $-2$ в $H_2S$) переходит в одну промежуточную степень окисления ($0$ в элементарной сере $S$).
Молекулярное уравнение:
$SO_2 + 2H_2S \rightarrow 3S \downarrow + 2H_2O$
Процессы окисления и восстановления:
$S^{+4} + 4e^- \rightarrow S^0$ | 1 (восстановление, $SO_2$ – окислитель)
$S^{-2} - 2e^- \rightarrow S^0$ | 2 (окисление, $H_2S$ – восстановитель)
Так как все участники реакции являются газами, неэлектролитами или слабыми электролитами, ионная форма уравнения совпадает с молекулярной. Реакция является окислительно-восстановительной.
Ответ: Продукты реакции – сера ($S$) и вода ($H_2O$). Реакция является окислительно-восстановительной.
в) Реакция горения серы в кислороде с образованием оксида серы(IV).
Молекулярное уравнение:
$S + O_2 \xrightarrow{t} SO_2$
Процессы окисления и восстановления:
$S^0 - 4e^- \rightarrow S^{+4}$ (окисление, $S$ – восстановитель)
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ (восстановление, $O_2$ – окислитель)
Реакция является окислительно-восстановительной. Ионные уравнения не составляются, так как все вещества – неэлектролиты.
Ответ: Продукт реакции – оксид серы(IV) ($SO_2$). Реакция является окислительно-восстановительной.
г) Каталитическое окисление оксида серы(IV) до оксида серы(VI). Реакция обратима и протекает при нагревании в присутствии катализатора (например, $V_2O_5$).
Молекулярное уравнение:
$2SO_2 + O_2 \rightleftharpoons 2SO_3$
Процессы окисления и восстановления:
$S^{+4} - 2e^- \rightarrow S^{+6}$ | 2 (окисление, $SO_2$ – восстановитель)
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 1 (восстановление, $O_2$ – окислитель)
Реакция является окислительно-восстановительной. Ионные уравнения не составляются, так как реагенты и продукты являются газами (молекулярными соединениями).
Ответ: Продукт реакции – оксид серы(VI) ($SO_3$). Реакция является окислительно-восстановительной.
д) Взаимодействие кислотного оксида $SO_2$ со щелочью $KOH$. В зависимости от соотношения реагентов могут образовываться средняя или кислая соль.
1. При соотношении $SO_2 : KOH = 1:2$ (в избытке щелочи) образуется средняя соль – сульфит калия:
Молекулярное уравнение: $SO_2 + 2KOH \rightarrow K_2SO_3 + H_2O$
Полное ионное уравнение: $SO_2 + 2K^+ + 2OH^- \rightarrow 2K^+ + SO_3^{2-} + H_2O$
Сокращенное ионное уравнение: $SO_2 + 2OH^- \rightarrow SO_3^{2-} + H_2O$
2. При соотношении $1:1$ образуется кислая соль – гидросульфит калия:
Молекулярное уравнение: $SO_2 + KOH \rightarrow KHSO_3$
Полное ионное уравнение: $SO_2 + K^+ + OH^- \rightarrow K^+ + HSO_3^{-}$
Сокращенное ионное уравнение: $SO_2 + OH^- \rightarrow HSO_3^{-}$
В обеих реакциях степени окисления элементов не меняются, следовательно, это реакции ионного обмена, а не окислительно-восстановительные.
Ответ: Продукты реакции – сульфит калия ($K_2SO_3$) и вода ($H_2O$), либо гидросульфит калия ($KHSO_3$). Реакция не является окислительно-восстановительной.
е) Взаимодействие кислотного оксида серы(VI) $SO_3$ с водой с образованием сильной серной кислоты $H_2SO_4$.
Молекулярное уравнение:
$SO_3 + H_2O \rightarrow H_2SO_4$
Серная кислота – сильный электролит, поэтому в водном растворе она диссоциирует. Ионное уравнение показывает образование ионов из молекул:
$SO_3 + H_2O \rightarrow 2H^+ + SO_4^{2-}$
Степени окисления элементов не изменяются ($S^{+6}, O^{-2}, H^{+1}$), следовательно, реакция не является окислительно-восстановительной.
Ответ: Продукт реакции – серная кислота ($H_2SO_4$). Реакция не является окислительно-восстановительной.
ё) Реакция между кислотным оксидом $SO_3$ и основанием (гидроксидом бария $Ba(OH)_2$) с образованием соли и воды.
Молекулярное уравнение:
$SO_3 + Ba(OH)_2 \rightarrow BaSO_4 \downarrow + H_2O$
Сульфат бария $BaSO_4$ – нерастворимое в воде вещество (выпадает в осадок). $Ba(OH)_2$ – сильное растворимое основание (щелочь).
Полное ионное уравнение:
$SO_3 + Ba^{2+} + 2OH^- \rightarrow BaSO_4 \downarrow + H_2O$
Так как в реакции нет одинаковых ионов в левой и правой частях, сокращенное ионное уравнение совпадает с полным. Реакция не является окислительно-восстановительной, так как степени окисления не изменяются.
Ответ: Продукты реакции – сульфат бария ($BaSO_4$) и вода ($H_2O$). Реакция не является окислительно-восстановительной.
ж) Реакция соединения кислотного оксида $SO_3$ и основного оксида $Na_2O$ с образованием соли – сульфата натрия.
Молекулярное уравнение:
$SO_3 + Na_2O \rightarrow Na_2SO_4$
Реакция протекает между твердыми веществами (или в расплаве), поэтому ионные уравнения для нее не записывают. Степени окисления элементов не изменяются ($S^{+6}, O^{-2}, Na^{+1}$), следовательно, реакция не является окислительно-восстановительной.
Ответ: Продукт реакции – сульфат натрия ($Na_2SO_4$). Реакция не является окислительно-восстановительной.
Вывод:
Окислительно-восстановительными из перечисленных являются реакции, в которых элементы изменяют свои степени окисления. К ним относятся:
- б) $SO_2 + 2H_2S \rightarrow 3S + 2H_2O$ (сопропорционирование)
- в) $S + O_2 \rightarrow SO_2$ (горение)
- г) $2SO_2 + O_2 \rightleftharpoons 2SO_3$ (окисление)
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 335 расположенного на странице 70 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №335 (с. 70), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














