Номер 58, страница 17 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава I. Повторение основных вопросов курса химии VIII класса. Параграф 4. Окислительно-восстановительные реакции - номер 58, страница 17.
№58 (с. 17)
Условие. №58 (с. 17)
скриншот условия
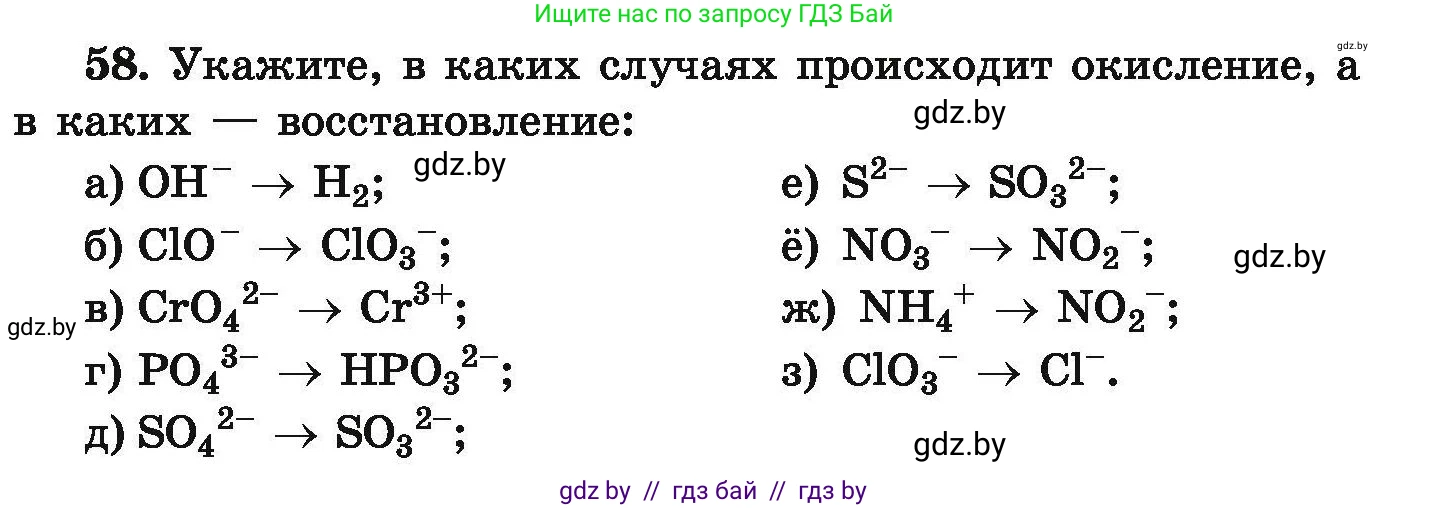
58. Укажите, в каких случаях происходит окисление, а в каких — восстановление:
а) $OH^- \rightarrow H_2$;
б) $ClO^- \rightarrow ClO_3^-$;
в) $CrO_4^{2-} \rightarrow Cr^{3+}$;
г) $PO_4^{3-} \rightarrow HPO_3^{2-}$;
д) $SO_4^{2-} \rightarrow SO_3^{2-}$;
е) $S^{2-} \rightarrow SO_3^{2-}$;
ё) $NO_3^- \rightarrow NO_2^-$;
ж) $NH_4^+ \rightarrow NO_2^-$;
з) $ClO_3^- \rightarrow Cl^-$.
Решение. №58 (с. 17)

Решение 2. №58 (с. 17)
Для определения, происходит ли окисление или восстановление, необходимо проанализировать изменение степеней окисления элементов в данных превращениях. Окисление — это процесс отдачи электронов, сопровождающийся повышением степени окисления. Восстановление — это процесс присоединения электронов, сопровождающийся понижением степени окисления.
а) OH⁻ → H₂Определим степени окисления водорода. В гидроксид-ионе ($OH^−$) степень окисления кислорода равна -2, а водорода +1. В молекуле водорода ($H_2$), как в простом веществе, степень окисления водорода равна 0. Степень окисления водорода изменяется с $H^{+1}$ до $H^0$. Происходит понижение степени окисления, следовательно, это процесс восстановления. Ответ: восстановление.
б) ClO⁻ → ClO₃⁻Определим степени окисления хлора. В гипохлорит-ионе ($ClO^−$) степень окисления кислорода -2, значит, степень окисления хлора +1 ($x + (-2) = -1$). В хлорат-ионе ($ClO_3^−$) степень окисления кислорода -2, значит, степень окисления хлора +5 ($x + 3 \cdot (-2) = -1$). Степень окисления хлора повышается с $+1$ до $+5$. Происходит повышение степени окисления, следовательно, это процесс окисления. Ответ: окисление.
в) CrO₄²⁻ → Cr³⁺Определим степени окисления хрома. В хромат-ионе ($CrO_4^{2−}$) степень окисления кислорода -2, значит, степень окисления хрома +6 ($x + 4 \cdot (-2) = -2$). В ионе хрома ($Cr^{3+}$) степень окисления равна его заряду, то есть +3. Степень окисления хрома понижается с $+6$ до $+3$. Происходит понижение степени окисления, следовательно, это процесс восстановления. Ответ: восстановление.
г) PO₄³⁻ → HPO₃²⁻Определим степени окисления фосфора. В фосфат-ионе ($PO_4^{3−}$) степень окисления кислорода -2, значит, степень окисления фосфора +5 ($x + 4 \cdot (-2) = -3$). В гидрофосфит-ионе ($HPO_3^{2−}$) степень окисления водорода +1, кислорода -2, значит, степень окисления фосфора +3 ($+1 + x + 3 \cdot (-2) = -2$). Степень окисления фосфора понижается с $+5$ до $+3$. Происходит понижение степени окисления, следовательно, это процесс восстановления. Ответ: восстановление.
д) SO₄²⁻ → SO₃²⁻Определим степени окисления серы. В сульфат-ионе ($SO_4^{2−}$) степень окисления кислорода -2, значит, степень окисления серы +6 ($x + 4 \cdot (-2) = -2$). В сульфит-ионе ($SO_3^{2−}$) степень окисления кислорода -2, значит, степень окисления серы +4 ($x + 3 \cdot (-2) = -2$). Степень окисления серы понижается с $+6$ до $+4$. Происходит понижение степени окисления, следовательно, это процесс восстановления. Ответ: восстановление.
e) S²⁻ → SO₃²⁻Определим степени окисления серы. В сульфид-ионе ($S^{2−}$) степень окисления серы равна заряду иона, то есть -2. В сульфит-ионе ($SO_3^{2−}$) степень окисления кислорода -2, значит, степень окисления серы +4 ($x + 3 \cdot (-2) = -2$). Степень окисления серы повышается с $-2$ до $+4$. Происходит повышение степени окисления, следовательно, это процесс окисления. Ответ: окисление.
ё) NO₃⁻ → NO₂⁻Определим степени окисления азота. В нитрат-ионе ($NO_3^−$) степень окисления кислорода -2, значит, степень окисления азота +5 ($x + 3 \cdot (-2) = -1$). В нитрит-ионе ($NO_2^−$) степень окисления кислорода -2, значит, степень окисления азота +3 ($x + 2 \cdot (-2) = -1$). Степень окисления азота понижается с $+5$ до $+3$. Происходит понижение степени окисления, следовательно, это процесс восстановления. Ответ: восстановление.
ж) NH₄⁺ → NO₂⁻Определим степени окисления азота. В ионе аммония ($NH_4^+$) степень окисления водорода +1, значит, степень окисления азота -3 ($x + 4 \cdot (+1) = +1$). В нитрит-ионе ($NO_2^−$) степень окисления кислорода -2, значит, степень окисления азота +3 ($x + 2 \cdot (-2) = -1$). Степень окисления азота повышается с $-3$ до $+3$. Происходит повышение степени окисления, следовательно, это процесс окисления. Ответ: окисление.
з) ClO₃⁻ → Cl⁻Определим степени окисления хлора. В хлорат-ионе ($ClO_3^−$) степень окисления кислорода -2, значит, степень окисления хлора +5 ($x + 3 \cdot (-2) = -1$). В хлорид-ионе ($Cl^−$) степень окисления хлора равна заряду иона, то есть -1. Степень окисления хлора понижается с $+5$ до $-1$. Происходит понижение степени окисления, следовательно, это процесс восстановления. Ответ: восстановление.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 58 расположенного на странице 17 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №58 (с. 17), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














