Номер 62, страница 18 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава I. Повторение основных вопросов курса химии VIII класса. Параграф 4. Окислительно-восстановительные реакции - номер 62, страница 18.
№62 (с. 18)
Условие. №62 (с. 18)
скриншот условия

62. Методом электронного баланса расставьте коэффициенты в следующих схемах окислительно-восстановительных реакций:
а) $Fe + O_2 \rightarrow Fe_3O_4$
б) $H_2S + O_2 \rightarrow SO_2 + H_2O$
в) $Cl_2 + FeCl_2 \rightarrow FeCl_3$
г) $Fe_2O_3 + H_2 \rightarrow Fe + H_2O$
д) $KClO_3 + S \rightarrow KCl + SO_2$
е) $SO_2 + O_2 \rightarrow SO_3$
ё) $H_2O_2 + HI \rightarrow I_2 + H_2O$
ж) $KNO_3 \rightarrow KNO_2 + O_2$
з) $NH_3 + O_2 \rightarrow N_2 + H_2O$
и) $HNO_2 \rightarrow HNO_3 + NO + H_2O$
й) $Cl_2 + KOH \rightarrow KCl + KClO_3 + H_2O$
к) $SO_2 + HNO_3 + H_2O \rightarrow H_2SO_4 + NO$
л) $FeS_2 + O_2 \rightarrow Fe_2O_3 + SO_2$
м) $NaI + H_2O_2 \rightarrow I_2 + NaOH$
Решение. №62 (с. 18)


Решение 2. №62 (с. 18)
а) Fe + O₂ → Fe₃O₄
Решение:
1. Определим степени окисления элементов:
$ \overset{0}{\text{Fe}} + \overset{0}{\text{O}}_2 \rightarrow \overset{+8/3}{\text{Fe}}_3\overset{-2}{\text{O}}_4 $
Железо $ \text{Fe} $ повышает свою степень окисления с 0 до +8/3, являясь восстановителем. Кислород $ \text{O} $ понижает свою степень окисления с 0 до -2, являясь окислителем. Fe₃O₄ является смешанным оксидом (FeO·Fe₂O₃), поэтому для составления баланса удобнее рассматривать суммарное изменение степени окисления для 3 атомов железа.
2. Составим полуреакции:
$ 3\text{Fe}^0 - 8e^- \rightarrow \text{Fe}_3^{+8} $ (процесс окисления)
$ \text{O}_2^0 + 4e^- \rightarrow 2\text{O}^{-2} $ (процесс восстановления)
3. Найдём наименьшее общее кратное (НОК) для числа отданных (8) и принятых (4) электронов. НОК(8, 4) = 8. Найдём множители:
$ \text{окисление: } 8e^- \div 8e^- = 1 $
$ \text{восстановление: } 8e^- \div 4e^- = 2 $
Таким образом, в балансе участвует 1 атомная группа $ \text{Fe}_3 $ и 2 молекулы $ \text{O}_2 $.
4. Расставим коэффициенты в уравнении реакции:
$ 3\text{Fe} + 2\text{O}_2 \rightarrow \text{Fe}_3\text{O}_4 $
Проверка: Fe (3 слева, 3 справа), O (4 слева, 4 справа). Баланс соблюдён.
Ответ: $ 3\text{Fe} + 2\text{O}_2 \rightarrow \text{Fe}_3\text{O}_4 $
б) H₂S + O₂ → SO₂ + H₂O
Решение:
1. Определим степени окисления:
$ \text{H}_2\overset{-2}{\text{S}} + \overset{0}{\text{O}}_2 \rightarrow \overset{+4}{\text{S}}\text{O}_2 + \text{H}_2\text{O} $
Сера $ \text{S} $ окисляется (с -2 до +4), кислород $ \text{O} $ восстанавливается (с 0 до -2).
2. Составим полуреакции:
$ \text{S}^{-2} - 6e^- \rightarrow \text{S}^{+4} $ (окисление)
$ \text{O}_2^0 + 4e^- \rightarrow 2\text{O}^{-2} $ (восстановление)
3. НОК(6, 4) = 12. Найдём множители:
$ \text{S}^{-2} \rightarrow \text{S}^{+4} $ | 2
$ \text{O}_2^0 \rightarrow 2\text{O}^{-2} $ | 3
4. Расставим коэффициенты:
$ 2\text{H}_2\text{S} + 3\text{O}_2 \rightarrow 2\text{SO}_2 + \text{H}_2\text{O} $
Уравняем водород, поставив коэффициент 2 перед $ \text{H}_2\text{O} $:
$ 2\text{H}_2\text{S} + 3\text{O}_2 \rightarrow 2\text{SO}_2 + 2\text{H}_2\text{O} $
Проверка: H (4 слева, 4 справа), S (2 слева, 2 справа), O (6 слева, 4+2=6 справа). Баланс соблюдён.
Ответ: $ 2\text{H}_2\text{S} + 3\text{O}_2 \rightarrow 2\text{SO}_2 + 2\text{H}_2\text{O} $
в) Cl₂ + FeCl₂ → FeCl₃
Решение:
1. Определим степени окисления:
$ \overset{0}{\text{Cl}}_2 + \overset{+2}{\text{Fe}}\text{Cl}_2 \rightarrow \overset{+3}{\text{Fe}}\overset{-1}{\text{Cl}}_3 $
Железо $ \text{Fe} $ окисляется (с +2 до +3), хлор $ \text{Cl} $ восстанавливается (с 0 до -1).
2. Составим полуреакции:
$ \text{Fe}^{+2} - 1e^- \rightarrow \text{Fe}^{+3} $ (окисление)
$ \text{Cl}_2^0 + 2e^- \rightarrow 2\text{Cl}^{-1} $ (восстановление)
3. НОК(1, 2) = 2. Найдём множители:
$ \text{Fe}^{+2} \rightarrow \text{Fe}^{+3} $ | 2
$ \text{Cl}_2^0 \rightarrow 2\text{Cl}^{-1} $ | 1
4. Расставим коэффициенты:
$ \text{Cl}_2 + 2\text{FeCl}_2 \rightarrow 2\text{FeCl}_3 $
Проверка: Cl (2 + 2*2 = 6 слева, 2*3 = 6 справа), Fe (2 слева, 2 справа). Баланс соблюдён.
Ответ: $ \text{Cl}_2 + 2\text{FeCl}_2 \rightarrow 2\text{FeCl}_3 $
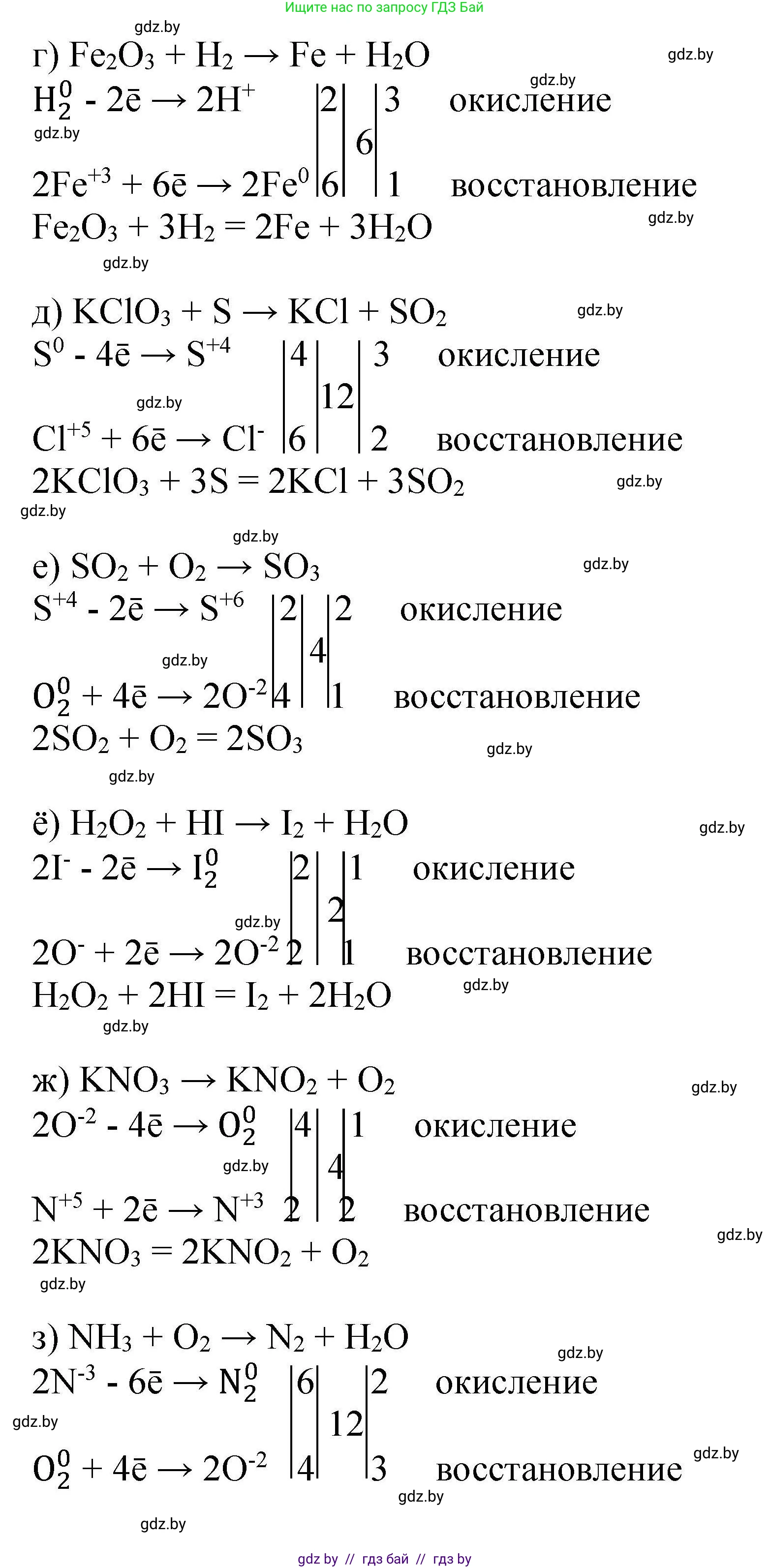
г) Fe₂O₃ + H₂ → Fe + H₂O
Решение:
1. Определим степени окисления:
$ \overset{+3}{\text{Fe}}_2\text{O}_3 + \overset{0}{\text{H}}_2 \rightarrow \overset{0}{\text{Fe}} + \overset{+1}{\text{H}}_2\text{O} $
Водород $ \text{H} $ окисляется (с 0 до +1), железо $ \text{Fe} $ восстанавливается (с +3 до 0).
2. Составим полуреакции:
$ \text{H}_2^0 - 2e^- \rightarrow 2\text{H}^{+1} $ (окисление)
$ \text{Fe}^{+3} + 3e^- \rightarrow \text{Fe}^{0} $ (восстановление)
3. НОК(2, 3) = 6. Найдём множители:
$ \text{H}_2^0 \rightarrow 2\text{H}^{+1} $ | 3
$ \text{Fe}^{+3} \rightarrow \text{Fe}^{0} $ | 2
4. Расставим коэффициенты:
$ \text{Fe}_2\text{O}_3 + 3\text{H}_2 \rightarrow 2\text{Fe} + \text{H}_2\text{O} $
Уравняем кислород и водород, поставив коэффициент 3 перед $ \text{H}_2\text{O} $:
$ \text{Fe}_2\text{O}_3 + 3\text{H}_2 \rightarrow 2\text{Fe} + 3\text{H}_2\text{O} $
Проверка: Fe (2 слева, 2 справа), O (3 слева, 3 справа), H (6 слева, 6 справа). Баланс соблюдён.
Ответ: $ \text{Fe}_2\text{O}_3 + 3\text{H}_2 \rightarrow 2\text{Fe} + 3\text{H}_2\text{O} $
д) KClO₃ + S → KCl + SO₂
Решение:
1. Определим степени окисления:
$ \text{K}\overset{+5}{\text{Cl}}\text{O}_3 + \overset{0}{\text{S}} \rightarrow \text{K}\overset{-1}{\text{Cl}} + \overset{+4}{\text{S}}\text{O}_2 $
Сера $ \text{S} $ окисляется (с 0 до +4), хлор $ \text{Cl} $ восстанавливается (с +5 до -1).
2. Составим полуреакции:
$ \text{S}^0 - 4e^- \rightarrow \text{S}^{+4} $ (окисление)
$ \text{Cl}^{+5} + 6e^- \rightarrow \text{Cl}^{-1} $ (восстановление)
3. НОК(4, 6) = 12. Найдём множители:
$ \text{S}^0 \rightarrow \text{S}^{+4} $ | 3
$ \text{Cl}^{+5} \rightarrow \text{Cl}^{-1} $ | 2
4. Расставим коэффициенты:
$ 2\text{KClO}_3 + 3\text{S} \rightarrow 2\text{KCl} + 3\text{SO}_2 $
Проверка: K (2 слева, 2 справа), Cl (2 слева, 2 справа), O (6 слева, 6 справа), S (3 слева, 3 справа). Баланс соблюдён.
Ответ: $ 2\text{KClO}_3 + 3\text{S} \rightarrow 2\text{KCl} + 3\text{SO}_2 $
е) SO₂ + O₂ → SO₃
Решение:
1. Определим степени окисления:
$ \overset{+4}{\text{S}}\text{O}_2 + \overset{0}{\text{O}}_2 \rightarrow \overset{+6}{\text{S}}\text{O}_3 $
Сера $ \text{S} $ окисляется (с +4 до +6), кислород $ \text{O} $ восстанавливается (с 0 до -2).
2. Составим полуреакции:
$ \text{S}^{+4} - 2e^- \rightarrow \text{S}^{+6} $ (окисление)
$ \text{O}_2^0 + 4e^- \rightarrow 2\text{O}^{-2} $ (восстановление)
3. НОК(2, 4) = 4. Найдём множители:
$ \text{S}^{+4} \rightarrow \text{S}^{+6} $ | 2
$ \text{O}_2^0 \rightarrow 2\text{O}^{-2} $ | 1
4. Расставим коэффициенты:
$ 2\text{SO}_2 + \text{O}_2 \rightarrow 2\text{SO}_3 $
Проверка: S (2 слева, 2 справа), O (4+2=6 слева, 2*3=6 справа). Баланс соблюдён.
Ответ: $ 2\text{SO}_2 + \text{O}_2 \rightarrow 2\text{SO}_3 $
ё) H₂O₂ + HI → I₂ + H₂O
Решение:
1. Определим степени окисления:
$ \text{H}_2\overset{-1}{\text{O}}_2 + \text{H}\overset{-1}{\text{I}} \rightarrow \overset{0}{\text{I}}_2 + \text{H}_2\overset{-2}{\text{O}} $
Йод $ \text{I} $ окисляется (с -1 до 0), кислород $ \text{O} $ восстанавливается (с -1 до -2).
2. Составим полуреакции:
$ 2\text{I}^{-1} - 2e^- \rightarrow \text{I}_2^0 $ (окисление)
$ \text{O}_2^{-2} + 2e^- \rightarrow 2\text{O}^{-2} $ (восстановление, рассматриваем два атома кислорода в пероксиде)
3. НОК(2, 2) = 2. Множители равны 1.
$ 2\text{I}^{-1} \rightarrow \text{I}_2^0 $ | 1
$ \text{O}_2^{-2} \rightarrow 2\text{O}^{-2} $ | 1
4. Расставим коэффициенты:
$ \text{H}_2\text{O}_2 + 2\text{HI} \rightarrow \text{I}_2 + \text{H}_2\text{O} $
Уравняем водород и кислород, поставив коэффициент 2 перед $ \text{H}_2\text{O} $:
$ \text{H}_2\text{O}_2 + 2\text{HI} \rightarrow \text{I}_2 + 2\text{H}_2\text{O} $
Проверка: H (2+2=4 слева, 4 справа), O (2 слева, 2 справа), I (2 слева, 2 справа). Баланс соблюдён.
Ответ: $ \text{H}_2\text{O}_2 + 2\text{HI} \rightarrow \text{I}_2 + 2\text{H}_2\text{O} $
ж) KNO₃ → KNO₂ + O₂
Решение:
1. Определим степени окисления:
$ \text{K}\overset{+5}{\text{N}}\overset{-2}{\text{O}}_3 \rightarrow \text{K}\overset{+3}{\text{N}}\text{O}_2 + \overset{0}{\text{O}}_2 $
Это реакция внутримолекулярного окисления-восстановления. Азот $ \text{N} $ восстанавливается (с +5 до +3), а кислород $ \text{O} $ окисляется (с -2 до 0).
2. Составим полуреакции:
$ 2\text{O}^{-2} - 4e^- \rightarrow \text{O}_2^0 $ (окисление)
$ \text{N}^{+5} + 2e^- \rightarrow \text{N}^{+3} $ (восстановление)
3. НОК(4, 2) = 4. Найдём множители:
$ 2\text{O}^{-2} \rightarrow \text{O}_2^0 $ | 1
$ \text{N}^{+5} \rightarrow \text{N}^{+3} $ | 2
4. Расставим коэффициенты: перед веществами с азотом ставим 2, перед кислородом 1.
$ 2\text{KNO}_3 \rightarrow 2\text{KNO}_2 + \text{O}_2 $
Проверка: K (2 слева, 2 справа), N (2 слева, 2 справа), O (2*3=6 слева, 2*2+2=6 справа). Баланс соблюдён.
Ответ: $ 2\text{KNO}_3 \rightarrow 2\text{KNO}_2 + \text{O}_2 $
з) NH₃ + O₂ → N₂ + H₂O
Решение:
1. Определим степени окисления:
$ \overset{-3}{\text{N}}\text{H}_3 + \overset{0}{\text{O}}_2 \rightarrow \overset{0}{\text{N}}_2 + \text{H}_2\overset{-2}{\text{O}} $
Азот $ \text{N} $ окисляется (с -3 до 0), кислород $ \text{O} $ восстанавливается (с 0 до -2).
2. Составим полуреакции:
$ 2\text{N}^{-3} - 6e^- \rightarrow \text{N}_2^0 $ (окисление)
$ \text{O}_2^0 + 4e^- \rightarrow 2\text{O}^{-2} $ (восстановление)
3. НОК(6, 4) = 12. Найдём множители:
$ 2\text{N}^{-3} \rightarrow \text{N}_2^0 $ | 2
$ \text{O}_2^0 \rightarrow 2\text{O}^{-2} $ | 3
4. Расставим коэффициенты: перед $ \text{NH}_3 $ ставим $ 2 \times 2 = 4 $, перед $ \text{N}_2 $ ставим 2, перед $ \text{O}_2 $ ставим 3.
$ 4\text{NH}_3 + 3\text{O}_2 \rightarrow 2\text{N}_2 + \text{H}_2\text{O} $
Уравняем водород, поставив коэффициент 6 перед $ \text{H}_2\text{O} $:
$ 4\text{NH}_3 + 3\text{O}_2 \rightarrow 2\text{N}_2 + 6\text{H}_2\text{O} $
Проверка: N (4 слева, 4 справа), H (12 слева, 12 справа), O (6 слева, 6 справа). Баланс соблюдён.
Ответ: $ 4\text{NH}_3 + 3\text{O}_2 \rightarrow 2\text{N}_2 + 6\text{H}_2\text{O} $
и) HNO₂ → HNO₃ + NO + H₂O
Решение:
1. Определим степени окисления:
$ \text{H}\overset{+3}{\text{N}}\text{O}_2 \rightarrow \text{H}\overset{+5}{\text{N}}\text{O}_3 + \overset{+2}{\text{N}}\text{O} + \text{H}_2\text{O} $
Это реакция диспропорционирования. Азот $ \text{N} $ из степени окисления +3 одновременно окисляется до +5 и восстанавливается до +2.
2. Составим полуреакции:
$ \text{N}^{+3} - 2e^- \rightarrow \text{N}^{+5} $ (окисление)
$ \text{N}^{+3} + 1e^- \rightarrow \text{N}^{+2} $ (восстановление)
3. НОК(2, 1) = 2. Найдём множители:
$ \text{N}^{+3} \rightarrow \text{N}^{+5} $ | 1
$ \text{N}^{+3} \rightarrow \text{N}^{+2} $ | 2
4. На 1 атом азота, перешедший в $ \text{HNO}_3 $, приходится 2 атома азота, перешедших в $ \text{NO} $. Всего в реакции участвует 1+2=3 молекулы $ \text{HNO}_2 $.
$ 3\text{HNO}_2 \rightarrow 1\text{HNO}_3 + 2\text{NO} + \text{H}_2\text{O} $
Проверка: H (3 слева, 1+2=3 справа), N (3 слева, 1+2=3 справа), O (3*2=6 слева, 3+2+1=6 справа). Баланс соблюдён.
Ответ: $ 3\text{HNO}_2 \rightarrow \text{HNO}_3 + 2\text{NO} + \text{H}_2\text{O} $
й) Cl₂ + KOH → KCl + KClO₃ + H₂O
Решение:
1. Определим степени окисления:
$ \overset{0}{\text{Cl}}_2 + \text{KOH} \rightarrow \text{K}\overset{-1}{\text{Cl}} + \text{K}\overset{+5}{\text{Cl}}\text{O}_3 + \text{H}_2\text{O} $
Это реакция диспропорционирования. Хлор $ \text{Cl} $ из степени окисления 0 одновременно окисляется до +5 и восстанавливается до -1.
2. Составим полуреакции:
$ \text{Cl}_2^0 - 10e^- \rightarrow 2\text{Cl}^{+5} $ (окисление)
$ \text{Cl}_2^0 + 2e^- \rightarrow 2\text{Cl}^{-1} $ (восстановление)
3. НОК(10, 2) = 10. Найдём множители:
$ \text{Cl}_2^0 \rightarrow 2\text{Cl}^{+5} $ | 1
$ \text{Cl}_2^0 \rightarrow 2\text{Cl}^{-1} $ | 5
4. На 1 молекулу $ \text{Cl}_2 $, окислившуюся до $ \text{KClO}_3 $, приходится 5 молекул $ \text{Cl}_2 $, восстановившихся до $ \text{KCl} $. Всего в реакции участвует 1+5=6 молекул $ \text{Cl}_2 $. Получаем коэффициенты: 1 перед $ \text{KClO}_3 $ (но так как в полуреакции 2 атома, то 2 перед $ \text{KClO}_3 $) и 5 перед $ \text{KCl} $ (а точнее 10). Чтобы избежать путаницы, лучше составлять баланс на 1 атом:
$ \text{Cl}^0 - 5e^- \rightarrow \text{Cl}^{+5} $ | 1
$ \text{Cl}^0 + 1e^- \rightarrow \text{Cl}^{-1} $ | 5
На 1 атом $ \text{Cl}^{+5} $ приходится 5 атомов $ \text{Cl}^{-1} $. Всего 6 атомов хлора, то есть 3 молекулы $ \text{Cl}_2 $.
$ 3\text{Cl}_2 + \text{KOH} \rightarrow 5\text{KCl} + 1\text{KClO}_3 + \text{H}_2\text{O} $
Уравняем калий: слева 1, справа 5+1=6. Ставим 6 перед $ \text{KOH} $.
$ 3\text{Cl}_2 + 6\text{KOH} \rightarrow 5\text{KCl} + \text{KClO}_3 + \text{H}_2\text{O} $
Уравняем водород: слева 6, справа 2. Ставим 3 перед $ \text{H}_2\text{O} $.
$ 3\text{Cl}_2 + 6\text{KOH} \rightarrow 5\text{KCl} + \text{KClO}_3 + 3\text{H}_2\text{O} $
Проверка: Cl(6/6), K(6/6), O(6/6), H(6/6). Баланс соблюдён.
Ответ: $ 3\text{Cl}_2 + 6\text{KOH} \rightarrow 5\text{KCl} + \text{KClO}_3 + 3\text{H}_2\text{O} $
к) SO₂ + HNO₃ + H₂O → H₂SO₄ + NO
Решение:
1. Определим степени окисления:
$ \overset{+4}{\text{S}}\text{O}_2 + \text{H}\overset{+5}{\text{N}}\text{O}_3 + \text{H}_2\text{O} \rightarrow \text{H}_2\overset{+6}{\text{S}}\text{O}_4 + \overset{+2}{\text{N}}\text{O} $
Сера $ \text{S} $ окисляется (с +4 до +6), азот $ \text{N} $ восстанавливается (с +5 до +2).
2. Составим полуреакции:
$ \text{S}^{+4} - 2e^- \rightarrow \text{S}^{+6} $ (окисление)
$ \text{N}^{+5} + 3e^- \rightarrow \text{N}^{+2} $ (восстановление)
3. НОК(2, 3) = 6. Найдём множители:
$ \text{S}^{+4} \rightarrow \text{S}^{+6} $ | 3
$ \text{N}^{+5} \rightarrow \text{N}^{+2} $ | 2
4. Расставим коэффициенты:
$ 3\text{SO}_2 + 2\text{HNO}_3 + \text{H}_2\text{O} \rightarrow 3\text{H}_2\text{SO}_4 + 2\text{NO} $
Уравняем водород и кислород. Слева H: 2 (из $ \text{HNO}_3 $) + 2 (из $ \text{H}_2\text{O} $) = 4. Справа H: 3*2 = 6. Необходимо изменить коэффициент перед $ \text{H}_2\text{O} $. Баланс H: $ 2 + 2x = 6 \implies 2x = 4 \implies x=2 $.
$ 3\text{SO}_2 + 2\text{HNO}_3 + 2\text{H}_2\text{O} \rightarrow 3\text{H}_2\text{SO}_4 + 2\text{NO} $
Проверка: S(3/3), N(2/2), H(2+4=6/6), O(6+6+2=14 / 12+2=14). Баланс соблюдён.
Ответ: $ 3\text{SO}_2 + 2\text{HNO}_3 + 2\text{H}_2\text{O} \rightarrow 3\text{H}_2\text{SO}_4 + 2\text{NO} $
л) FeS₂ + O₂ → Fe₂O₃ + SO₂
Решение:
1. Определим степени окисления. В пирите $ \text{FeS}_2 $ железо имеет с.о. +2, а сера -1.
$ \overset{+2}{\text{Fe}}\overset{-1}{\text{S}}_2 + \overset{0}{\text{O}}_2 \rightarrow \overset{+3}{\text{Fe}}_2\overset{-2}{\text{O}}_3 + \overset{+4}{\text{S}}\overset{-2}{\text{O}}_2 $
Окисляются и железо (с +2 до +3) и сера (с -1 до +4). Кислород восстанавливается (с 0 до -2).
2. Составим суммарную полуреакцию окисления для $ \text{FeS}_2 $ и полуреакцию восстановления для $ \text{O}_2 $:
$ \text{Fe}^{+2} - 1e^- \rightarrow \text{Fe}^{+3} $
$ 2\text{S}^{-1} - 10e^- \rightarrow 2\text{S}^{+4} $ (каждый атом серы отдает 5 электронов)
Суммарно: $ \text{FeS}_2 - 11e^- \rightarrow \text{Fe}^{+3} + 2\text{S}^{+4} $ (окисление)
$ \text{O}_2^0 + 4e^- \rightarrow 2\text{O}^{-2} $ (восстановление)
3. НОК(11, 4) = 44. Найдём множители:
$ \text{FeS}_2 \rightarrow \text{Fe}^{+3} + 2\text{S}^{+4} $ | 4
$ \text{O}_2^0 \rightarrow 2\text{O}^{-2} $ | 11
4. Расставим коэффициенты: 4 перед $ \text{FeS}_2 $ и 11 перед $ \text{O}_2 $.
$ 4\text{FeS}_2 + 11\text{O}_2 \rightarrow \text{Fe}_2\text{O}_3 + \text{SO}_2 $
Уравняем Fe и S в правой части: $ 4\text{Fe} \rightarrow 2\text{Fe}_2\text{O}_3 $ и $ 8\text{S} \rightarrow 8\text{SO}_2 $.
$ 4\text{FeS}_2 + 11\text{O}_2 \rightarrow 2\text{Fe}_2\text{O}_3 + 8\text{SO}_2 $
Проверка: Fe(4/4), S(8/8), O(22 / 6+16=22). Баланс соблюдён.
Ответ: $ 4\text{FeS}_2 + 11\text{O}_2 \rightarrow 2\text{Fe}_2\text{O}_3 + 8\text{SO}_2 $
м) NaI + H₂O₂ → I₂ + NaOH
Решение:
1. Определим степени окисления:
$ \text{Na}\overset{-1}{\text{I}} + \text{H}_2\overset{-1}{\text{O}}_2 \rightarrow \overset{0}{\text{I}}_2 + \text{Na}\overset{-2}{\text{O}}\text{H} $
Йод $ \text{I} $ окисляется (с -1 до 0), кислород $ \text{O} $ из пероксида водорода восстанавливается (с -1 до -2).
2. Составим полуреакции:
$ 2\text{I}^{-1} - 2e^- \rightarrow \text{I}_2^0 $ (окисление)
$ \text{O}_2^{-2} + 2e^- \rightarrow 2\text{O}^{-2} $ (восстановление)
3. НОК(2, 2) = 2. Множители равны 1.
$ 2\text{I}^{-1} \rightarrow \text{I}_2^0 $ | 1
$ \text{O}_2^{-2} \rightarrow 2\text{O}^{-2} $ | 1
4. Расставим коэффициенты. Перед $ \text{NaI} $ ставим 2, перед $ \text{H}_2\text{O}_2 $ и $ \text{I}_2 $ ставим 1.
$ 2\text{NaI} + \text{H}_2\text{O}_2 \rightarrow \text{I}_2 + \text{NaOH} $
Уравняем натрий, поставив 2 перед $ \text{NaOH} $.
$ 2\text{NaI} + \text{H}_2\text{O}_2 \rightarrow \text{I}_2 + 2\text{NaOH} $
Проверка: Na(2/2), I(2/2), H(2/2), O(2/2). Баланс соблюдён.
Ответ: $ 2\text{NaI} + \text{H}_2\text{O}_2 \rightarrow \text{I}_2 + 2\text{NaOH} $
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 62 расположенного на странице 18 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №62 (с. 18), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














