Номер 64, страница 19 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава I. Повторение основных вопросов курса химии VIII класса. Параграф 4. Окислительно-восстановительные реакции - номер 64, страница 19.
№64 (с. 19)
Условие. №64 (с. 19)
скриншот условия

64. В результате взаимодействия азота и водорода образовался аммиак объёмом (н. у.) 2,24 $дм^3$. Рассчитайте химические количества водорода и азота, вступивших в реакцию.
Решение. №64 (с. 19)
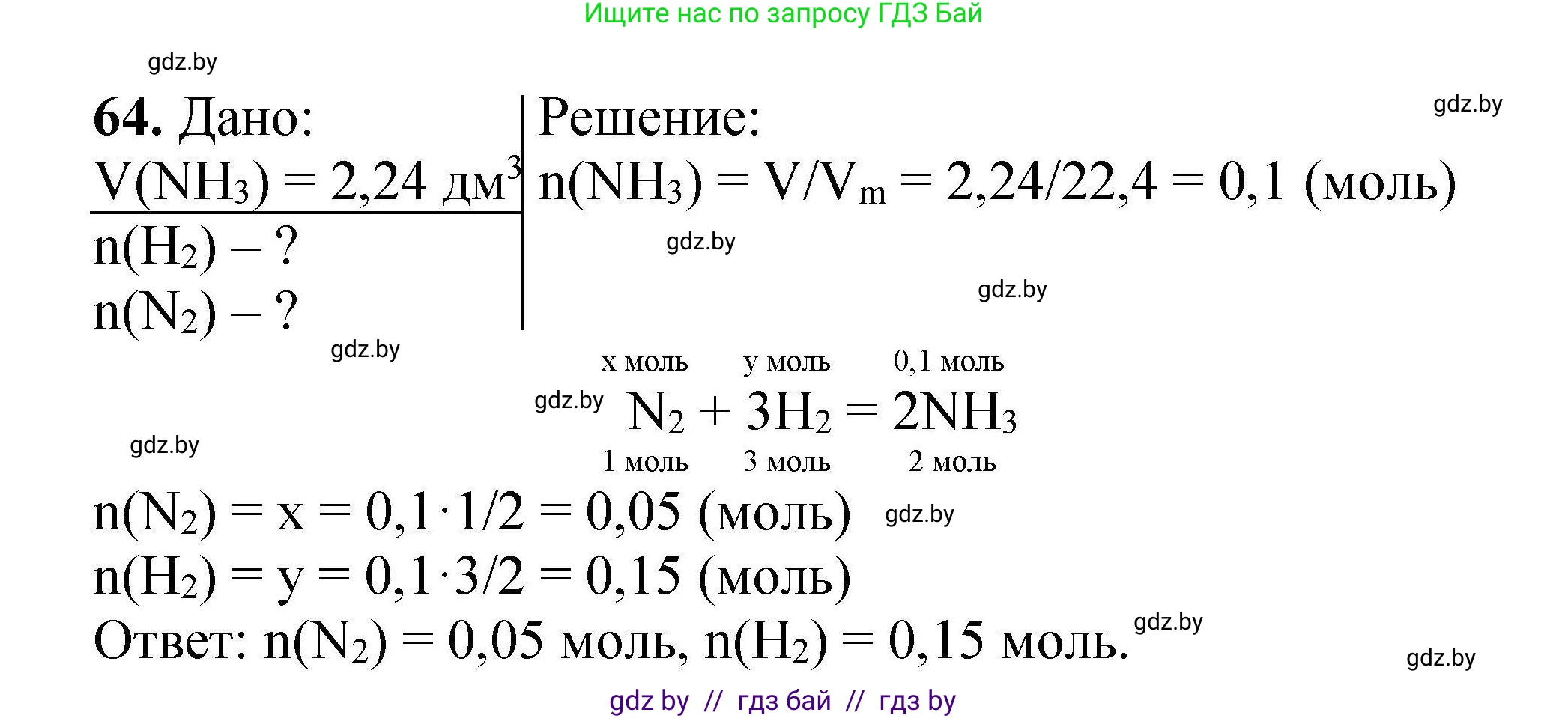
Решение 2. №64 (с. 19)
Дано:
Объем аммиака $V(\text{NH}_3) = 2,24 \text{ дм}^3$
Условия: н. у. (нормальные условия)
Перевод в СИ:
$V(\text{NH}_3) = 2,24 \text{ дм}^3 = 2,24 \cdot 10^{-3} \text{ м}^3$
Найти:
$n(\text{N}_2) - ?$
$n(\text{H}_2) - ?$
Решение:
1. Запишем уравнение реакции синтеза аммиака из азота и водорода. Это обратимая реакция, но для стехиометрических расчетов мы можем представить ее в виде:
$ \text{N}_2 + 3\text{H}_2 \rightleftharpoons 2\text{NH}_3 $
Из уравнения реакции следует, что 1 моль азота реагирует с 3 молями водорода, образуя 2 моля аммиака. Таким образом, соотношение химических количеств (в молях) участвующих веществ равно их стехиометрическим коэффициентам:
$ n(\text{N}_2) : n(\text{H}_2) : n(\text{NH}_3) = 1 : 3 : 2 $
2. Рассчитаем химическое количество (количество вещества) аммиака, зная его объем при нормальных условиях (н. у.). При н. у. молярный объем любого газа $V_m$ составляет 22,4 дм³/моль.
Химическое количество $n$ вычисляется по формуле:
$ n = \frac{V}{V_m} $
Подставим известные значения для аммиака:
$ n(\text{NH}_3) = \frac{V(\text{NH}_3)}{V_m} = \frac{2,24 \text{ дм}^3}{22,4 \text{ дм}^3/\text{моль}} = 0,1 \text{ моль} $
3. Используя пропорции из уравнения реакции, найдем химические количества азота и водорода, которые вступили в реакцию для образования 0,1 моль аммиака.
Найдем химическое количество азота $n(\text{N}_2)$. Согласно соотношению $n(\text{N}_2) : n(\text{NH}_3) = 1 : 2$, количество азота в 2 раза меньше количества аммиака:
$ n(\text{N}_2) = \frac{1}{2} \cdot n(\text{NH}_3) = \frac{1}{2} \cdot 0,1 \text{ моль} = 0,05 \text{ моль} $
Найдем химическое количество водорода $n(\text{H}_2)$. Согласно соотношению $n(\text{H}_2) : n(\text{NH}_3) = 3 : 2$, количество водорода составляет $3/2$ от количества аммиака:
$ n(\text{H}_2) = \frac{3}{2} \cdot n(\text{NH}_3) = \frac{3}{2} \cdot 0,1 \text{ моль} = 0,15 \text{ моль} $
Ответ: химическое количество азота, вступившего в реакцию, составляет $n(\text{N}_2) = 0,05 \text{ моль}$; химическое количество водорода, вступившего в реакцию, составляет $n(\text{H}_2) = 0,15 \text{ моль}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 64 расположенного на странице 19 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №64 (с. 19), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














