Номер 7, страница 32 - гдз по химии 10 класс учебник Колевич, Матулис

Авторы: Колевич Т. А., Матулис В. Э., Матулис В. Э., Варакса И. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: синий
ISBN: 978-985-599-068-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 1. Введение в органическую химию. Параграф 5. Предмет органической химии. Теория строения органических веществ - номер 7, страница 32.
№7 (с. 32)
Условие. №7 (с. 32)
скриншот условия

7. При пропускании газообразных продуктов полного окисления органического вещества массой 0,508 г через избыток известковой воды было получено 3,600 г осадка. Вычислите массовую долю (%) углерода в органическом веществе.
Решение. №7 (с. 32)
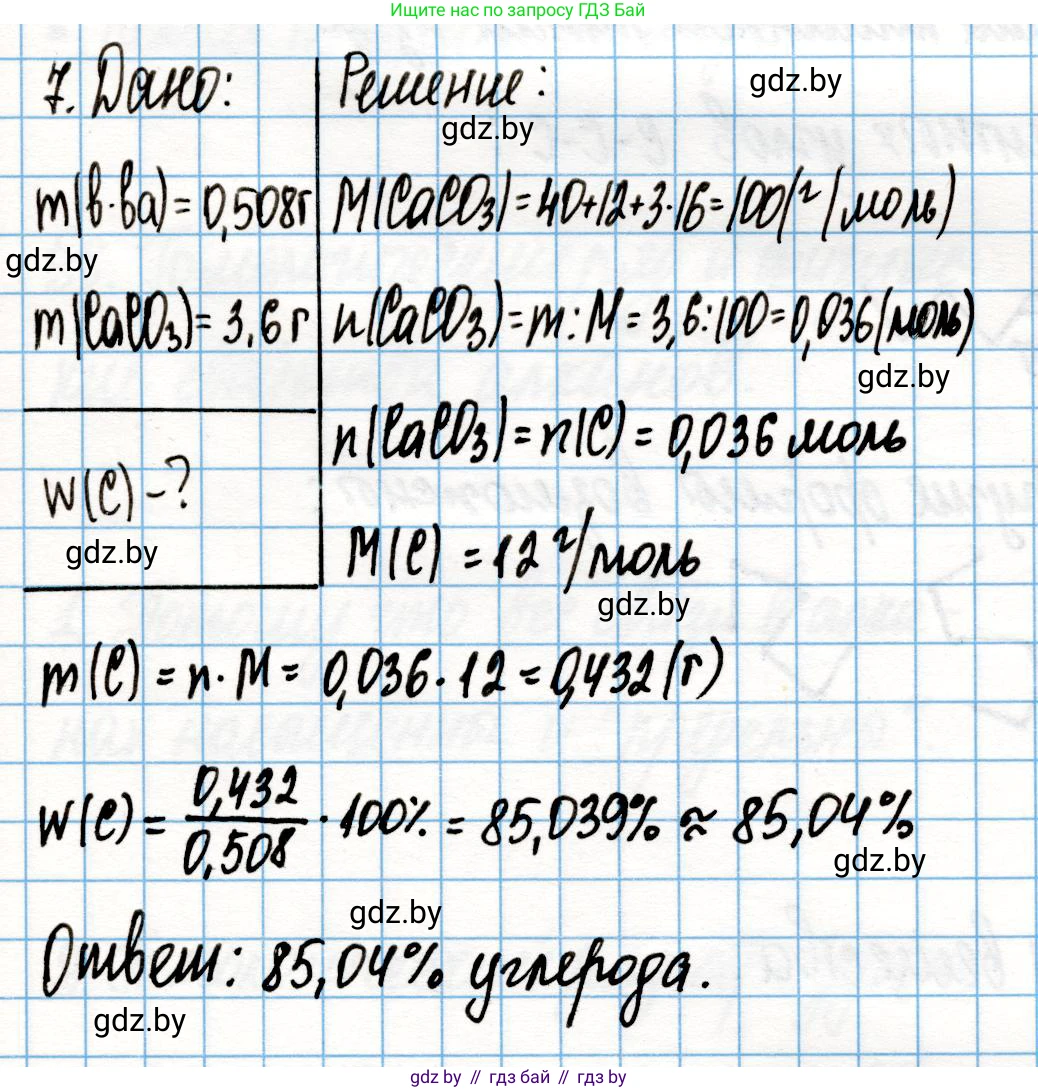
Решение 2. №7 (с. 32)
Дано:
масса органического вещества $m_{орг. в-ва} = 0,508 \text{ г}$
масса осадка $m_{осадка} = 3,600 \text{ г}$
Найти:
массовую долю углерода $\omega(C)$ - ?
Решение:
При полном окислении (сгорании) органического вещества весь углерод, входящий в его состав, превращается в углекислый газ ($CO_2$). Водород (если он есть) превращается в воду ($H_2O$).
При пропускании газообразных продуктов сгорания через избыток известковой воды (раствор гидроксида кальция $Ca(OH)_2$) углекислый газ вступает в реакцию, образуя нерастворимый в воде осадок — карбонат кальция ($CaCO_3$). Уравнение этой реакции:
$CO_2 + Ca(OH)_2 \rightarrow CaCO_3 \downarrow + H_2O$
Так как известковая вода была в избытке, весь углекислый газ прореагировал. Это означает, что весь углерод из исходного органического вещества теперь находится в составе осадка $CaCO_3$. Таким образом, мы можем найти массу углерода в осадке, и это будет масса углерода в исходном веществе.
1. Вычислим молярную массу карбоната кальция ($CaCO_3$). Для расчетов будем использовать целочисленные относительные атомные массы: $Ar(Ca) = 40$, $Ar(C) = 12$, $Ar(O) = 16$.
$M(CaCO_3) = Ar(Ca) + Ar(C) + 3 \cdot Ar(O) = 40 + 12 + 3 \cdot 16 = 100 \text{ г/моль}$
2. Найдем количество вещества (моль) образовавшегося осадка $CaCO_3$.
$n(CaCO_3) = \frac{m(CaCO_3)}{M(CaCO_3)} = \frac{3,600 \text{ г}}{100 \text{ г/моль}} = 0,036 \text{ моль}$
3. Из химической формулы $CaCO_3$ видно, что в одной формульной единице карбоната кальция содержится один атом углерода (C). Следовательно, количество вещества атомов углерода равно количеству вещества карбоната кальция.
$n(C) = n(CaCO_3) = 0,036 \text{ моль}$
4. Найдем массу углерода, которая содержалась в исходной навеске органического вещества. Молярная масса углерода $M(C) = 12 \text{ г/моль}$.
$m(C) = n(C) \cdot M(C) = 0,036 \text{ моль} \cdot 12 \text{ г/моль} = 0,432 \text{ г}$
5. Рассчитаем массовую долю углерода ($\omega$) в исходном органическом веществе по формуле:
$\omega(C) = \frac{m(C)}{m_{орг. в-ва}} \cdot 100\%$
$\omega(C) = \frac{0,432 \text{ г}}{0,508 \text{ г}} \cdot 100\% \approx 85,039...\% \approx 85,04\%$
Ответ: массовая доля углерода в органическом веществе составляет 85,04%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 7 расположенного на странице 32 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 32), авторов: Колевич (Татьяна Александровна), Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Варакса (Игорь Николаевич), учебного пособия издательства Адукацыя i выхаванне.














