Номер 1, страница 250 - гдз по химии 10 класс учебник Колевич, Матулис

Авторы: Колевич Т. А., Матулис В. Э., Матулис В. Э., Варакса И. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: синий
ISBN: 978-985-599-068-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 4. Азотсодержащие органические соединения. Параграф 45. Строение и физические свойства аминов - номер 1, страница 250.
№1 (с. 250)
Условие. №1 (с. 250)
скриншот условия

1. Приведите примеры реакций, в которых аммиак проявляет свойства основания.
Какая частица присоединяется к молекуле аммиака в этих реакциях?
Решение. №1 (с. 250)
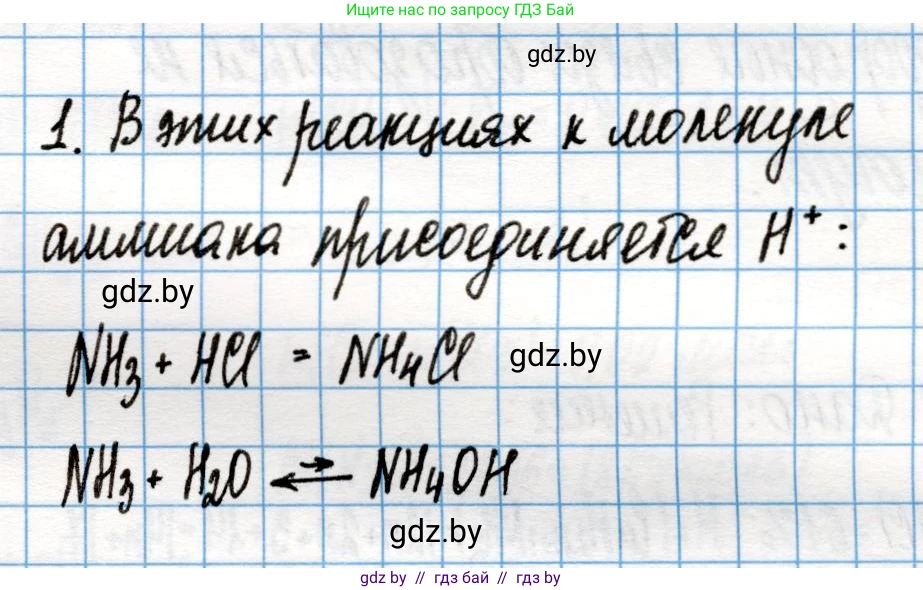
Решение 2. №1 (с. 250)
Приведите примеры реакций, в которых аммиак проявляет свойства основания.
Аммиак ($NH_3$) проявляет свойства слабого основания благодаря наличию у атома азота неподелённой (свободной) электронной пары. Эта пара способна образовывать ковалентную связь с протоном ($H^+$) по донорно-акцепторному механизму. Таким образом, аммиак является основанием по теории Брёнстеда-Лоури (как акцептор протонов) и основанием Льюиса (как донор электронной пары).
Примеры таких реакций:
1. Взаимодействие с водой. При растворении в воде аммиак вступает в обратимую реакцию, принимая протон от молекулы воды. В результате образуются ион аммония и гидроксид-ион, который обуславливает щелочную среду раствора:
$NH_3 + H_2O \rightleftharpoons NH_4^+ + OH^-$
2. Взаимодействие с кислотами. Аммиак активно реагирует с кислотами, образуя соли аммония. Это типичные реакции нейтрализации.
- Реакция с соляной кислотой с образованием хлорида аммония:
$NH_3 + HCl \rightarrow NH_4Cl$
- Реакция с серной кислотой с образованием сульфата аммония:
$2NH_3 + H_2SO_4 \rightarrow (NH_4)_2SO_4$
Какая частица присоединяется к молекуле аммиака в этих реакциях?
В реакциях, где аммиак выступает в роли основания, к его молекуле присоединяется протон (катион водорода, $H^+$). Атом азота в молекуле аммиака ($NH_3$), имея свободную электронную пару, выступает донором, а протон ($H^+$), имея вакантную 1s-орбиталь, выступает акцептором. Между ними образуется донорно-акцепторная ковалентная связь, в результате чего образуется сложный катион — ион аммония ($NH_4^+$).
Ответ: Примерами реакций, в которых аммиак проявляет свойства основания, являются его взаимодействие с водой ($NH_3 + H_2O \rightleftharpoons NH_4^+ + OH^-$) и с кислотами, например, с соляной ($NH_3 + HCl \rightarrow NH_4Cl$). В этих реакциях к молекуле аммиака присоединяется протон (катион водорода, $H^+$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 1 расположенного на странице 250 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 250), авторов: Колевич (Татьяна Александровна), Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Варакса (Игорь Николаевич), учебного пособия издательства Адукацыя i выхаванне.














