Практическая работа 4, страница 272 - гдз по химии 10 класс учебник Колевич, Матулис

Авторы: Колевич Т. А., Матулис В. Э., Матулис В. Э., Варакса И. Н.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: синий
ISBN: 978-985-599-068-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 10 классе
Глава 4. Азотсодержащие органические соединения. Параграф 48. Белки - страница 272.
Практическая работа 4 (с. 272)
Условие. Практическая работа 4 (с. 272)
скриншот условия


Практическая работа 4
Решение экспериментальных задач
Вариант 1
Окисление этанола до уксусного альдегидаВ пробирку с газоотводной трубкой поместите 0,5 г дихромата калия ($K_2Cr_2O_7$), 2 $см^3$ разбавленной серной кислоты и 2 $см^3$ этанола, смесь встряхните. Наблюдается разогревание смеси и изменение её окраски.
Добавьте в пробирку центры кипения, закрепите её наклонно и опустите газоотводную трубку почти до дна другой пробирки, содержащей 2 $см^3$ холодной воды и помещённой в стакан со льдом. Осторожно нагрейте реакционную смесь. В течение 2–3 минут объём смеси в пробирке-приёмнике увеличивается почти вдвое, после этого нагревание прекратите и разберите прибор. Присутствие альдегида определите по запаху и с помощью качественных реакций.
Вариант 2
Выделение высших жирных кислот из мыла. Образование нерастворимых солей высших жирных кислотВ стакане растворите 1 г мыльной стружки в 10 $см^3$ дистиллированной воды (почему дистиллированной?). Полученный раствор разделите на три части.
К первой прилейте 2 $см^3$ 10%-го раствора серной кислоты. Смесь нагрейте почти до кипения. Расплавившиеся жирные кислоты всплывают в виде слоя, затвердевающего при охлаждении раствора.
Во вторую пробирку прилейте 1 $см^3$ 5%-го раствора хлорида кальция. К осадку кальциевой соли прилейте 10%-й раствор уксусной кислоты. Осадок растворяется, происходит выделение жирных кислот, образующих при нагревании маслянистый слой.
В третью пробирку прилейте 1 $см^3$ 5%-го раствора медного купороса. Пробирку с осадком медной соли нагрейте до начала кипения, при этом соль всплывает в виде изумрудно-зелёного кольца. Если в растворе имеется избыток натриевого мыла, опыт не удаётся. В этом случае добавьте ещё немного 5%-го раствора медного купороса и снова нагрейте смесь до кипения.
Вариант 3
Высаливание мылаВ пробирку налейте 3–5 $см^3$ водного раствора мыла, подогрейте его и внесите при перемешивании сухой хлорид натрия. По мере насыщения раствора солью растворимость мыла уменьшается, раствор начинает мутнеть, и, наконец, натриевое мыло всплывает над прозрачной жидкостью в виде творожистых хлопьев. Этот процесс называют высаливанием, его часто применяют в лабораторной практике и в промышленности при выделении органических веществ из водных растворов.
Вариант 4
Получение сложного эфираВ пробирку поместите по 2–3 $см^3$ этилового либо изоамилового спирта (3-метилбутанола-1), затем примерно такой же объём уксусной кислоты. Добавьте 1 $см^3$ концентрированной серной кислоты. Для равномерного кипения добавьте немного сухого песка либо фарфоровых крошек. Закройте пробирку пробкой с длинной трубкой, которая служит обратным холодильником. Нагревайте пробирку в течение нескольких минут. После охлаждения налейте в пробирку несколько $см^3$ воды. Жидкость расслоится. Верхний слой — сложный эфир. При использовании изоамилового спирта сложный эфир имеет запах груш.
Решение. Практическая работа 4 (с. 272)
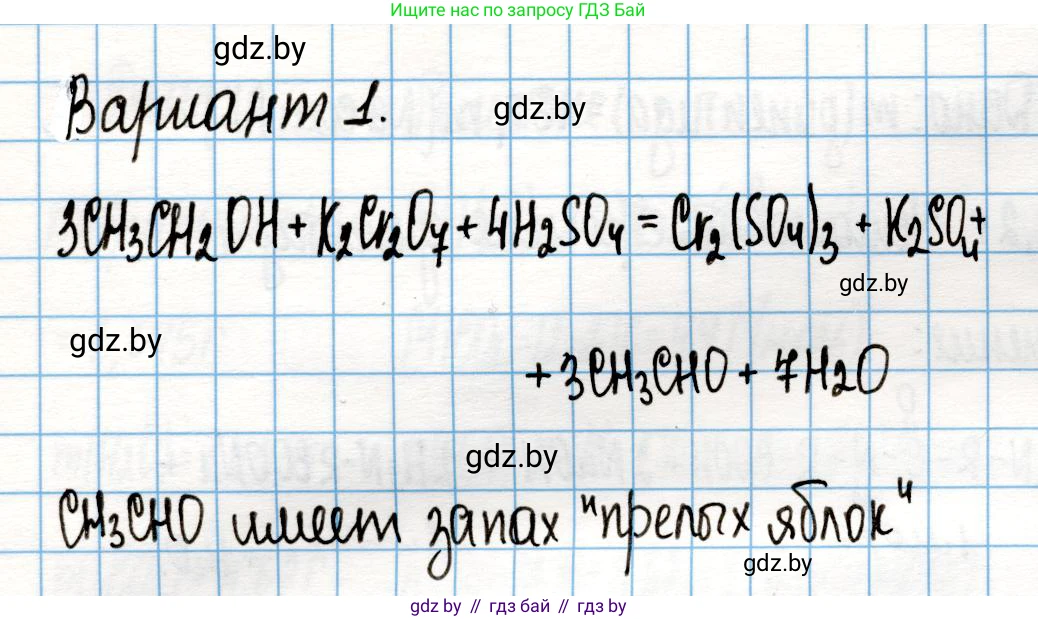


Решение 2. Практическая работа 4 (с. 272)
Вариант 1. Окисление этанола до уксусного альдегида
Решение:
В данном эксперименте описывается процесс окисления первичного спирта, этанола, до альдегида — уксусного альдегида (этаналя). В качестве окислителя используется дихромат калия ($K_2Cr_2O_7$) в кислой среде, создаваемой серной кислотой ($H_2SO_4$).
Уравнение химической реакции в молекулярном виде:
$3C_2H_5OH + K_2Cr_2O_7 + 4H_2SO_4 \rightarrow 3CH_3CHO + Cr_2(SO_4)_3 + K_2SO_4 + 7H_2O$
При смешивании реагентов наблюдаются следующие явления:
- Разогревание смеси: Реакция окисления является экзотермической, то есть протекает с выделением значительного количества тепла.
- Изменение окраски: Раствор меняет свой цвет с оранжевого на зелёный. Это происходит потому, что ионы дихромата ($Cr_2O_7^{2-}$), имеющие оранжевую окраску, в ходе реакции восстанавливаются до ионов хрома(III) ($Cr^{3+}$), которые в водном растворе сульфата имеют характерный зелёный цвет.
Далее производится выделение продукта реакции. Уксусный альдегид имеет очень низкую температуру кипения (20.2 °C), что значительно ниже, чем у этанола (78.4 °C) и воды (100 °C). Благодаря этому, при осторожном нагревании реакционной смеси, летучий альдегид испаряется первым. Его пары по газоотводной трубке поступают в пробирку-приёмник. Чтобы собрать продукт, приёмник необходимо охлаждать (в данном случае он помещён в стакан со льдом), что приводит к конденсации паров альдегида обратно в жидкое состояние. Увеличение объёма жидкости в приёмнике подтверждает успешное протекание реакции и процесса перегонки.
Присутствие полученного уксусного альдегида можно определить по его характерному резкому запаху, напоминающему запах прелых яблок. Для более точной идентификации можно провести качественные реакции на альдегидную группу, например, реакцию "серебряного зеркала" с аммиачным раствором оксида серебра или реакцию с фелинговой жидкостью (гидроксидом меди(II)) при нагревании, в ходе которой образуется красный осадок оксида меди(I).
Ответ:
В ходе эксперимента этанол окисляется дихроматом калия в сернокислой среде до уксусного альдегида. Реакция является экзотермической и сопровождается изменением цвета раствора с оранжевого на зелёный. Образовавшийся летучий альдегид выделяется из реакционной смеси методом перегонки с последующей конденсацией в охлаждаемом приёмнике. Продукт идентифицируется по характерному запаху.
Вариант 2. Выделение высших жирных кислот из мыла. Образование нерастворимых солей высших жирных кислот
Решение:
В данном варианте рассматриваются химические свойства мыла как соли высшей жирной кислоты и сильного основания. Мыло (в данном случае твёрдое) — это, как правило, натриевая соль высшей карбоновой кислоты, например, стеарат натрия $C_{17}H_{35}COONa$.
Для проведения опытов мыло растворяют в дистиллированной воде. На вопрос "почему дистиллированной?" ответ следующий: водопроводная вода содержит растворённые соли, в частности ионы кальция ($Ca^{2+}$) и магния ($Mg^{2+}$), которые вызывают её "жёсткость". Эти ионы реагируют с мылом, образуя нерастворимые в воде кальциевые и магниевые соли жирных кислот, что приводит к появлению осадка и мешает проведению экспериментов.
1. Выделение высших жирных кислот из мыла.
К раствору мыла добавляют сильную минеральную кислоту, например, серную ($H_2SO_4$). Происходит реакция ионного обмена, в ходе которой сильная кислота вытесняет слабую жирную кислоту из её соли:
$2C_{17}H_{35}COONa + H_2SO_4 \rightarrow 2C_{17}H_{35}COOH\downarrow + Na_2SO_4$
Высшие жирные кислоты (в данном примере — стеариновая кислота $C_{17}H_{35}COOH$) нерастворимы в воде. При нагревании смеси они плавятся и, будучи легче воды, всплывают на поверхность, образуя маслянистый слой, который при охлаждении застывает.
2. Образование нерастворимых солей высших жирных кислот.
а) Взаимодействие с хлоридом кальция ($CaCl_2$). При добавлении к раствору мыла раствора хлорида кальция выпадает белый творожистый осадок стеарата кальция:
$2C_{17}H_{35}COONa + CaCl_2 \rightarrow (C_{17}H_{35}COO)_2Ca\downarrow + 2NaCl$
Этот осадок можно растворить, добавив к нему более сильную кислоту, чем стеариновая, например, уксусную ($CH_3COOH$). Уксусная кислота вытеснит стеариновую из её соли:
$(C_{17}H_{35}COO)_2Ca + 2CH_3COOH \rightarrow 2C_{17}H_{35}COOH\downarrow + (CH_3COO)_2Ca$
Выделившаяся свободная жирная кислота при нагревании образует маслянистый слой.
б) Взаимодействие с медным купоросом ($CuSO_4$). При добавлении к раствору мыла раствора сульфата меди(II) образуется голубовато-зелёный осадок стеарата меди(II):
$2C_{17}H_{35}COONa + CuSO_4 \rightarrow (C_{17}H_{35}COO)_2Cu\downarrow + Na_2SO_4$
При нагревании эта соль плавится и всплывает на поверхность в виде изумрудно-зелёного кольца. Если в растворе остаётся избыток мыла, которое является поверхностно-активным веществом, оно может эмульгировать соль меди, мешая ей собраться в отчётливый слой. В этом случае необходимо добавить ещё немного раствора сульфата меди для полного осаждения мыла.
Ответ:
Опыты показывают, что мыло, являясь солью слабой жирной кислоты, реагирует с более сильными кислотами с выделением свободной жирной кислоты, нерастворимой в воде. Также мыло образует нерастворимые осадки с солями металлов, например, кальция и меди. Опыты следует проводить в дистиллированной воде, чтобы исключить реакции с ионами жёсткости.
Вариант 3. Высаливание мыла
Решение:
Процесс, описанный в данном варианте, называется высаливанием. Высаливание — это процесс уменьшения растворимости некоторых веществ (в данном случае мыла, которое является коллоидным раствором) в воде путем добавления больших количеств электролитов, таких как хлорид натрия ($NaCl$).
Механизм этого явления заключается в следующем. Молекулы мыла (например, стеарата натрия $C_{17}H_{35}COONa$) в воде диссоциируют на ионы $C_{17}H_{35}COO^-$ и $Na^+$. Анионы жирной кислоты состоят из длинной гидрофобной (отталкивающей воду) углеводородной цепи и небольшой гидрофильной (притягивающей воду) карбоксильной группы ($-COO^-$). В воде молекулы воды образуют гидратные оболочки вокруг гидрофильных групп, что и обеспечивает растворимость мыла.
Когда в раствор добавляется большое количество поваренной соли, она диссоциирует на ионы $Na^+$ и $Cl^-$. Эти ионы также гидратируются, то есть связывают молекулы воды. Из-за высокой концентрации ионов $Na^+$ и $Cl^-$ они "отнимают" молекулы воды у ионов мыла. В результате гидратные оболочки вокруг карбоксильных групп разрушаются, растворимость мыла резко падает, и оно выделяется из раствора в виде творожистых хлопьев, которые всплывают на поверхность.
Этот процесс имеет большое практическое значение. В промышленности высаливание используется на заключительном этапе производства мыла для его отделения от глицерина и избытка щёлочи.
Ответ:
Высаливание мыла — это процесс его осаждения из водного раствора путем добавления концентрированного раствора электролита (например, $NaCl$). Это происходит из-за того, что ионы электролита гидратируются, связывая молекулы воды и тем самым снижая растворимость мыла.
Вариант 4. Получение сложного эфира
Решение:
В данном эксперименте описывается синтез сложного эфира в результате реакции этерификации — взаимодействия спирта с карбоновой кислотой. В качестве реагентов используются уксусная кислота ($CH_3COOH$) и один из спиртов: этиловый ($C_2H_5OH$) или изоамиловый (3-метилбутанол-1, $(CH_3)_2CHCH_2CH_2OH$).
Реакция этерификации является обратимой и катализируется сильными кислотами. В данном случае в качестве катализатора используется концентрированная серная кислота ($H_2SO_4$).
Уравнение реакции для получения изоамилацетата (сложного эфира изоамилового спирта и уксусной кислоты):
$CH_3COOH + (CH_3)_2CHCH_2CH_2OH \rightleftharpoons CH_3COOCH_2CH_2CH(CH_3)_2 + H_2O$
Роль компонентов и этапов процесса:
- Концентрированная серная кислота ($H_2SO_4$) выполняет две функции: во-первых, она является катализатором, ускоряющим достижение равновесия. Во-вторых, она является сильным водоотнимающим средством. Связывая воду, которая является продуктом реакции, серная кислота смещает химическое равновесие вправо, в сторону образования сложного эфира (согласно принципу Ле Шателье), увеличивая его выход.
- Нагревание и обратный холодильник. Реакция этерификации протекает медленно при комнатной температуре, поэтому для её ускорения смесь нагревают. Чтобы летучие компоненты (спирт, кислота, эфир) не испарялись из пробирки, её закрывают пробкой с длинной стеклянной трубкой, которая выполняет роль простого воздушного обратного холодильника. Пары, поднимаясь по трубке, охлаждаются, конденсируются и стекают обратно в реакционную смесь.
- Песок или фарфоровые крошки добавляют в качестве "центров кипения" для обеспечения равномерного и спокойного кипения жидкости без толчков.
- Добавление воды после реакции. После охлаждения реакционную смесь выливают в воду. Сложные эфиры плохо растворимы в воде и, как правило, легче неё. Поэтому жидкость расслаивается, и сложный эфир образует верхний слой. Этот приём позволяет отделить эфир от водорастворимых примесей: непрореагировавших спирта и уксусной кислоты, а также от катализатора — серной кислоты.
Полученный сложный эфир (изоамилацетат) обладает характерным приятным запахом, напоминающим запах груш (эссенция "Дюшес").
Ответ:
В результате катализируемой серной кислотой реакции этерификации между уксусной кислотой и спиртом (этиловым или изоамиловым) образуется соответствующий сложный эфир. Серная кислота выступает катализатором и водоотнимающим агентом, увеличивая выход продукта. Продукт выделяют, выливая реакционную смесь в воду, где он образует отдельный слой. Изоамилацетат, продукт реакции с изоамиловым спиртом, имеет характерный запах груши.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения Практическая работа 4 расположенного на странице 272 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Практическая работа 4 (с. 272), авторов: Колевич (Татьяна Александровна), Матулис (Вадим Эдвардович), Матулис (Виталий Эдвардович), Варакса (Игорь Николаевич), учебного пособия издательства Адукацыя i выхаванне.














