Номер 4, страница 83 - гдз по химии 11 класс учебник Мычко, Прохоревич

Авторы: Мычко Д. И., Прохоревич К. Н., Борушко И. И.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2021 - 2025
Цвет обложки: зелёный с колбами
ISBN: 978-985-599-297-5
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава III. Химическая связь и строение вещества. Параграф 14. Свойства химических связей - номер 4, страница 83.
№4 (с. 83)
Условия. №4 (с. 83)
скриншот условия
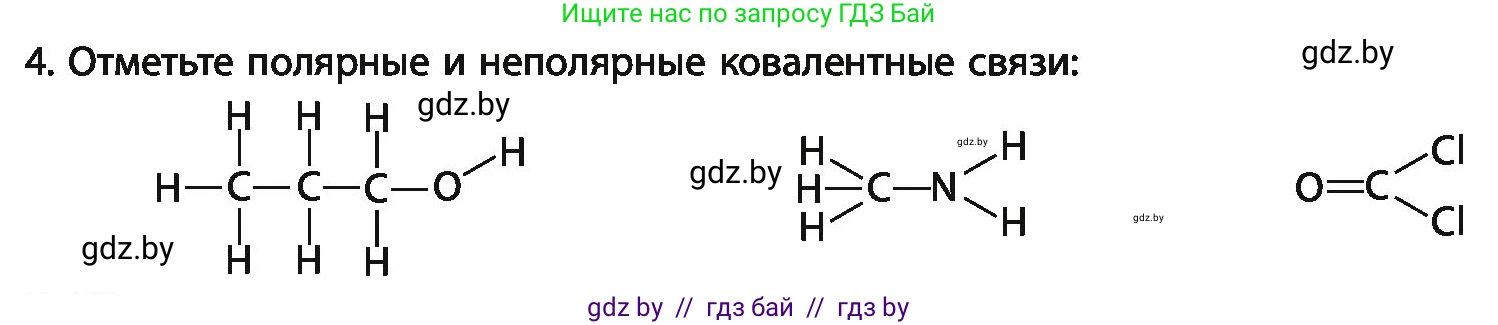
4. Отметьте полярные и неполярные ковалентные связи:
$\text{H}\text{--}\underset{\text{H}}{\overset{\text{H}}{\text{C}}}\text{--}\underset{\text{H}}{\overset{\text{H}}{\text{C}}}\text{--}\text{O}\text{--}\text{H}$ $\quad\quad$ $\underset{\text{H}}{\overset{\text{H}}{\text{H}\text{--}\text{C}}}\text{--}\text{N}\begin{array}{l}/ \text{H} \backslash \text{H}\end{array}$ $\quad\quad$ $\text{O}=\text{C}\begin{array}{l}/ \text{Cl} \backslash \text{Cl}\end{array}$
Решение. №4 (с. 83)
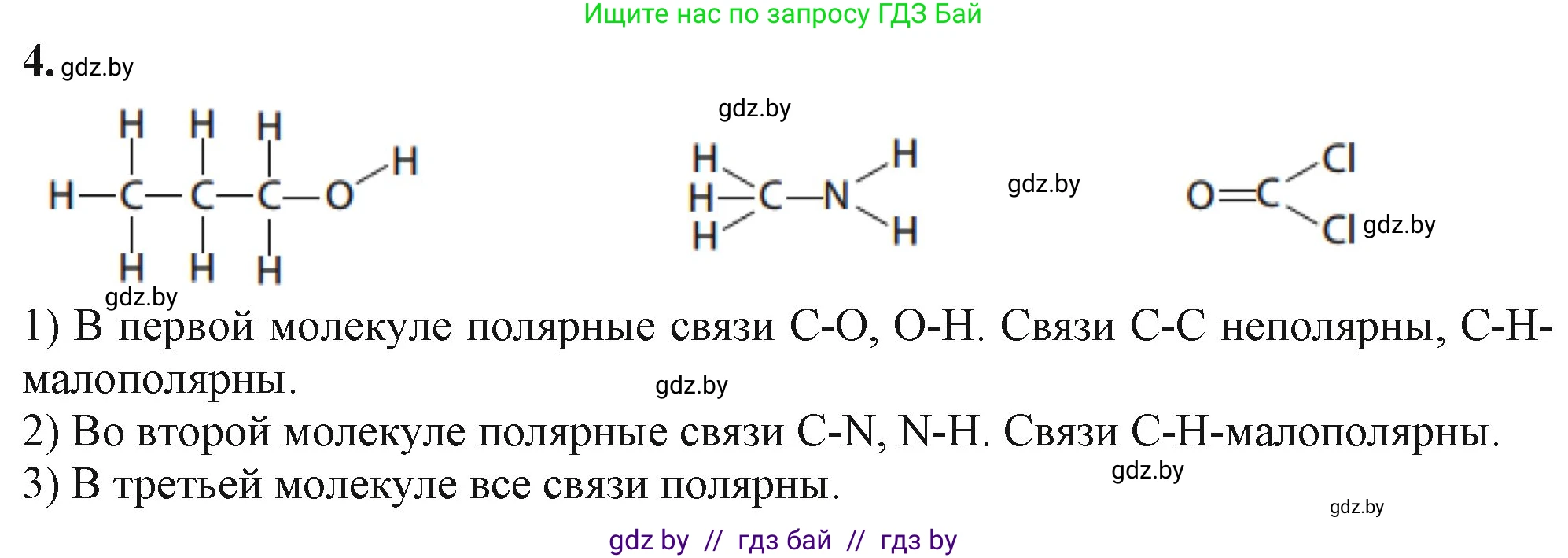
Решение 2. №4 (с. 83)
Для определения полярности ковалентной связи необходимо сравнить значения электроотрицательности (ЭО) атомов, образующих эту связь. Ковалентная связь является неполярной, если она образована атомами с одинаковой или очень близкой электроотрицательностью (разница $\Delta ЭО < 0.4$). Если разница в электроотрицательности значительна ($\Delta ЭО \ge 0.4$), то общая электронная пара смещается к более электроотрицательному атому, и связь становится полярной.
Используем значения электроотрицательности по Полингу: H (Водород) - 2.20; C (Углерод) - 2.55; N (Азот) - 3.04; O (Кислород) - 3.44; Cl (Хлор) - 3.16.
Молекула 1: Пропан-1-ол ($CH_3CH_2CH_2OH$)
В данной молекуле присутствуют следующие типы связей:
- C–C (углерод-углерод): связь образована одинаковыми атомами, поэтому разница электроотрицательностей равна нулю ($\Delta ЭО = 2.55 - 2.55 = 0$). Эта связь является неполярной.
- C–H (углерод-водород): разница электроотрицательностей невелика: $\Delta ЭО = 2.55 - 2.20 = 0.35$. Такую связь принято считать неполярной.
- C–O (углерод-кислород): разница электроотрицательностей существенна: $\Delta ЭО = 3.44 - 2.55 = 0.89$. Электронная плотность смещена к атому кислорода. Эта связь является полярной.
- O–H (кислород-водород): разница электроотрицательностей велика: $\Delta ЭО = 3.44 - 2.20 = 1.24$. Электронная плотность сильно смещена к атому кислорода. Эта связь является полярной.
Ответ: неполярные связи: C–C, C–H; полярные связи: C–O, O–H.
Молекула 2: Метиламин ($CH_3NH_2$)
В данной молекуле присутствуют следующие типы связей:
- C–H (углерод-водород): $\Delta ЭО = 2.55 - 2.20 = 0.35$. Связь является неполярной.
- C–N (углерод-азот): разница электроотрицательностей составляет $\Delta ЭО = 3.04 - 2.55 = 0.49$. Электронная плотность смещена к атому азота. Эта связь является полярной.
- N–H (азот-водород): разница электроотрицательностей значительна: $\Delta ЭО = 3.04 - 2.20 = 0.84$. Электронная плотность смещена к атому азота. Эта связь является полярной.
Ответ: неполярные связи: C–H; полярные связи: C–N, N–H.
Молекула 3: Фосген ($COCl_2$)
В данной молекуле присутствуют следующие типы связей:
- C=O (углерод-кислород, двойная связь): разница электроотрицательностей существенна: $\Delta ЭО = 3.44 - 2.55 = 0.89$. Электронная плотность смещена к атому кислорода. Эта связь является полярной.
- C–Cl (углерод-хлор): разница электроотрицательностей составляет $\Delta ЭО = 3.16 - 2.55 = 0.61$. Электронная плотность смещена к атому хлора. Эта связь является полярной.
Ответ: неполярные связи: нет; полярные связи: C=O, C–Cl.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 4 расположенного на странице 83 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 83), авторов: Мычко (Дмитрий Иванович), Прохоревич (Константин Николаевич), Борушко (Ирина Ивановна), учебного пособия издательства Адукацыя i выхаванне.













