Номер 7, страница 76 - гдз по химии 11 класс учебник Мычко, Прохоревич

Авторы: Мычко Д. И., Прохоревич К. Н., Борушко И. И.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2021 - 2025
Цвет обложки: зелёный с колбами
ISBN: 978-985-599-297-5
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава III. Химическая связь и строение вещества. Параграф 13. Природа и типы химической связи - номер 7, страница 76.
№7 (с. 76)
Условия. №7 (с. 76)
скриншот условия

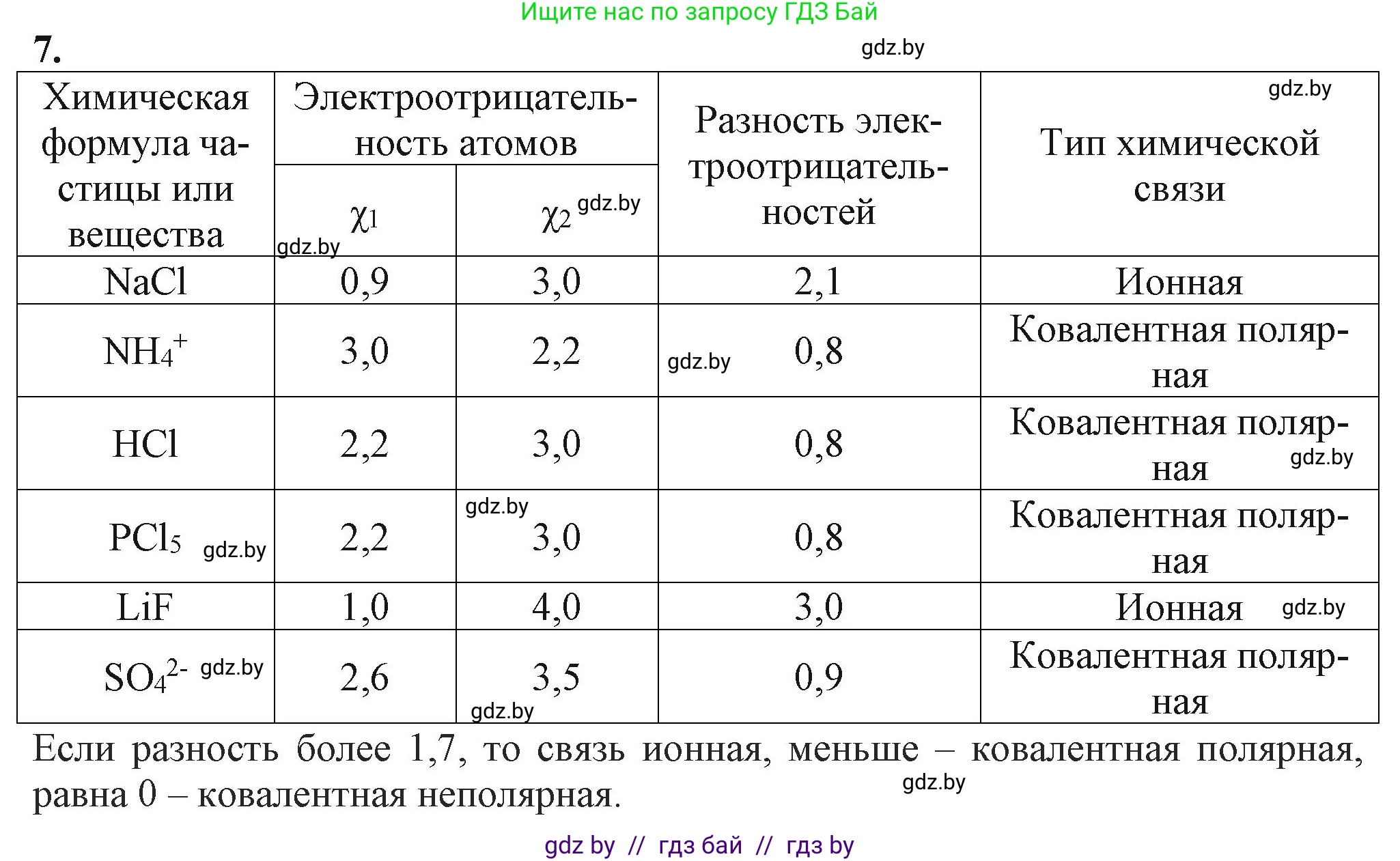
7. Используя значения электроотрицательности элементов (табл. 7), дайте обоснование типу химической связи в веществах и частицах: NaCl, $NH_4^+$, HCl, $PCl_5$, LiF, $SO_4^{2-}$.
| Химическая формула вещества или частицы | Электроотрицательность атомов | Разность электроотрицательностей $ \Delta\chi $ | Тип химической связи | |
|---|---|---|---|---|
| $ \chi_1 $ | $ \chi_2 $ | |||
Решение. №7 (с. 76)
Решение 2. №7 (с. 76)
Дано:
Вещества и частицы: NaCl, NH₄⁺, HCl, PCl₅, LiF, SO₄²⁻.
Значения электроотрицательности (ЭО) по шкале Полинга:
$χ(Na) = 0.93$
$χ(Cl) = 3.16$
$χ(N) = 3.04$
$χ(H) = 2.20$
$χ(P) = 2.19$
$χ(Li) = 0.98$
$χ(F) = 3.98$
$χ(S) = 2.58$
$χ(O) = 3.44$
Электроотрицательность является безразмерной величиной, поэтому перевод в систему СИ не требуется.
Найти:
Обосновать тип химической связи для каждого указанного вещества и частицы.
Решение:
Тип химической связи можно определить на основе разности электроотрицательностей ($Δχ$) атомов, образующих связь. Общепринятая классификация:
Если $Δχ > 1.7$, связь является ионной.
Если $0.4 < Δχ ≤ 1.7$, связь является ковалентной полярной.
Если $Δχ ≤ 0.4$, связь является ковалентной неполярной.
Проведем расчет для каждого случая.
NaCl
Связь образуется между атомом металла натрия (Na) и атомом неметалла хлора (Cl). Рассчитаем разность их электроотрицательностей:
$Δχ = |χ(Cl) - χ(Na)| = |3.16 - 0.93| = 2.23$
Поскольку разность электроотрицательностей $2.23 > 1.7$, связь между натрием и хлором является ионной. Происходит практически полный перенос валентного электрона от атома натрия к атому хлора с образованием ионов $Na^+$ и $Cl^-$.
Ответ: ионная связь.
NH₄⁺
В ионе аммония NH₄⁺ связи образуются между атомом азота (N) и четырьмя атомами водорода (H). Рассчитаем разность электроотрицательностей для связи N-H:
$Δχ = |χ(N) - χ(H)| = |3.04 - 2.20| = 0.84$
Так как $0.4 < 0.84 ≤ 1.7$, связи N-H являются ковалентными полярными. Общие электронные пары смещены к более электроотрицательному атому азота. Одна из связей образуется по донорно-акцепторному механизму, но по своим характеристикам не отличается от остальных.
Ответ: ковалентная полярная связь.
HCl
Связь в молекуле хлороводорода существует между атомом водорода (H) и атомом хлора (Cl). Рассчитаем разность электроотрицательностей:
$Δχ = |χ(Cl) - χ(H)| = |3.16 - 2.20| = 0.96$
Поскольку $0.4 < 0.96 ≤ 1.7$, связь H-Cl является ковалентной полярной. Электронная плотность смещена к атому хлора, в результате на нем возникает частичный отрицательный заряд ($δ^−$), а на атоме водорода — частичный положительный ($δ^+$).
Ответ: ковалентная полярная связь.
PCl₅
В молекуле пентахлорида фосфора связи образуются между центральным атомом фосфора (P) и пятью атомами хлора (Cl). Рассчитаем разность электроотрицательностей для связи P-Cl:
$Δχ = |χ(Cl) - χ(P)| = |3.16 - 2.19| = 0.97$
Значение $0.97$ находится в диапазоне $0.4 < Δχ ≤ 1.7$, следовательно, все пять связей P-Cl являются ковалентными полярными.
Ответ: ковалентная полярная связь.
LiF
Связь образуется между атомом щелочного металла лития (Li) и атомом галогена фтора (F), который является самым электроотрицательным элементом. Рассчитаем разность электроотрицательностей:
$Δχ = |χ(F) - χ(Li)| = |3.98 - 0.98| = 3.00$
Разность электроотрицательностей очень велика ($3.00 > 1.7$), что указывает на образование ионной связи за счет перехода электрона от атома лития к атому фтора и образования ионов $Li^+$ и $F^-$.
Ответ: ионная связь.
SO₄²⁻
В сульфат-ионе SO₄²⁻ связи образуются между центральным атомом серы (S) и четырьмя атомами кислорода (O). Рассчитаем разность электроотрицательностей для связи S-O:
$Δχ = |χ(O) - χ(S)| = |3.44 - 2.58| = 0.86$
Поскольку $0.4 < 0.86 ≤ 1.7$, связи S-O в сульфат-ионе являются ковалентными полярными. Электронная плотность смещена к более электроотрицательным атомам кислорода.
Ответ: ковалентная полярная связь.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 7 расположенного на странице 76 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 76), авторов: Мычко (Дмитрий Иванович), Прохоревич (Константин Николаевич), Борушко (Ирина Ивановна), учебного пособия издательства Адукацыя i выхаванне.













