Номер 4, страница 76 - гдз по химии 11 класс учебник Мычко, Прохоревич

Авторы: Мычко Д. И., Прохоревич К. Н., Борушко И. И.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2021 - 2025
Цвет обложки: зелёный с колбами
ISBN: 978-985-599-297-5
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава III. Химическая связь и строение вещества. Параграф 13. Природа и типы химической связи - номер 4, страница 76.
№4 (с. 76)
Условия. №4 (с. 76)
скриншот условия

4. Сравните электронные схемы и электронные конфигурации:
а) атома $Li$ и иона $Li^+$ в бромиде лития;
б) атома $Cl$ и иона $Cl^-$ в хлориде калия;
в) атома $S$ и атома серы в молекуле сероводорода.
Решение. №4 (с. 76)

Решение 2. №4 (с. 76)
а) атома Li и иона Li⁺ в бромиде лития
Атом лития ($Li$) находится в периодической системе под номером 3. Заряд его ядра +3, и в нейтральном атоме содержится 3 электрона.
Электронная конфигурация атома лития: $Li: 1s^2 2s^1$.
Электронная схема (распределение по энергетическим уровням): $Li: )_2 )_1$.
На внешнем энергетическом уровне у атома лития находится один валентный электрон.
В соединении бромид лития ($LiBr$) между атомами лития и брома образуется ионная связь. Атом лития, как типичный металл, легко отдает свой единственный валентный электрон атому брома, превращаясь в положительно заряженный ион (катион) лития $Li^+$.
Катион лития $Li^+$ имеет тот же заряд ядра +3, но содержит только 2 электрона (на один меньше, чем протонов).
Электронная конфигурация иона лития: $Li^+: 1s^2$.
Электронная схема: $Li^+: )_2$.
Сравнение: Атом лития имеет два электронных слоя, причем внешний слой ($n=2$) не завершен. Ион лития $Li^+$ имеет всего один, но завершенный электронный слой, такой же, как у инертного газа гелия ($He$), что делает его электронную оболочку очень стабильной. Атом $Li$ электронейтрален, а ион $Li^+$ имеет заряд +1.
Ответ: Атом лития ($Li$) имеет электронную конфигурацию $1s^2 2s^1$ и два электронных слоя ($)_2 )_1$). При образовании ионной связи в бромиде лития он отдает один электрон, превращаясь в катион $Li^+$, который имеет стабильную, завершенную электронную конфигурацию $1s^2$ и один электронный слой ($)_2$), как у гелия.
б) атома Cl и иона Cl⁻ в хлориде калия
Атом хлора ($Cl$) находится в периодической системе под номером 17. Заряд его ядра +17, и в нейтральном атоме содержится 17 электронов.
Электронная конфигурация атома хлора: $Cl: 1s^2 2s^2 2p^6 3s^2 3p^5$.
Электронная схема: $Cl: )_2 )_8 )_7$.
На внешнем энергетическом уровне у атома хлора находится 7 электронов, до завершения слоя (октета) не хватает одного электрона.
В соединении хлорид калия ($KCl$) образуется ионная связь. Атом хлора, как типичный неметалл с высокой электроотрицательностью, принимает один электрон от атома калия, превращаясь в отрицательно заряженный ион (анион) хлора $Cl^-$.
Хлорид-ион $Cl^-$ имеет тот же заряд ядра +17, но содержит 18 электронов (на один больше, чем протонов).
Электронная конфигурация иона хлора: $Cl^-: 1s^2 2s^2 2p^6 3s^2 3p^6$.
Электронная схема: $Cl^-: )_2 )_8 )_8$.
Сравнение: Атом хлора имеет три электронных слоя, причем внешний слой не завершен. Хлорид-ион $Cl^-$ также имеет три электронных слоя, но его внешний слой завершен (содержит 8 электронов), такой же, как у инертного газа аргона ($Ar$), что делает его электронную оболочку очень стабильной. Атом $Cl$ электронейтрален, а ион $Cl^-$ имеет заряд -1.
Ответ: Атом хлора ($Cl$) имеет электронную конфигурацию $1s^2 2s^2 2p^6 3s^2 3p^5$ и незавершенный внешний слой с 7 электронами. При образовании ионной связи в хлориде калия он принимает один электрон, превращаясь в анион $Cl^-$, который имеет стабильную, завершенную электронную конфигурацию $1s^2 2s^2 2p^6 3s^2 3p^6$, как у аргона.
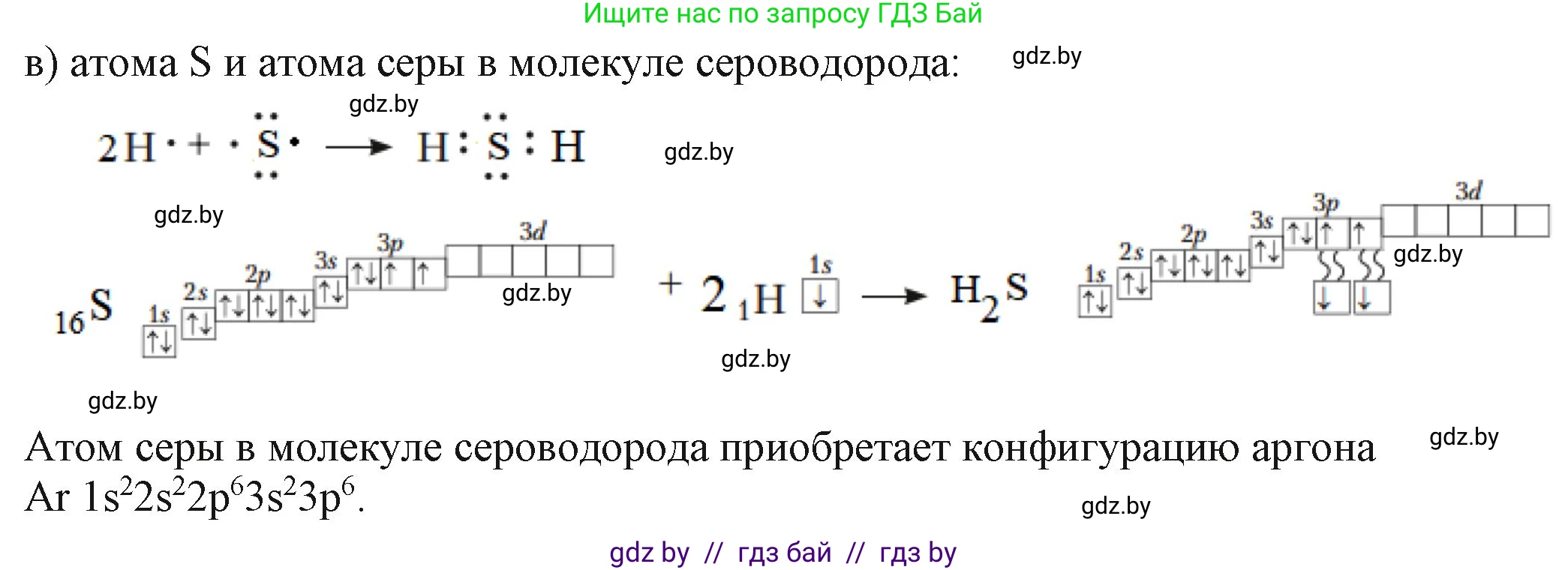
в) атома S и атома серы в молекуле сероводорода
Атом серы ($S$) находится в периодической системе под номером 16. Заряд его ядра +16, и в нейтральном атоме содержится 16 электронов.
Электронная конфигурация атома серы: $S: 1s^2 2s^2 2p^6 3s^2 3p^4$.
Электронная схема: $S: )_2 )_8 )_6$.
На внешнем энергетическом уровне у атома серы находится 6 электронов. Из них два электрона на $3p$-подуровне неспаренные, и именно они могут участвовать в образовании ковалентных связей.
В молекуле сероводорода ($H_2S$) между атомом серы и двумя атомами водорода образуются ковалентные полярные связи. В этом случае не происходит полного перехода электронов, как в ионных соединениях. Атом серы образует общие электронные пары с атомами водорода.
Каждый из двух неспаренных $3p$-электронов атома серы образует общую электронную пару с $1s$-электроном одного из атомов водорода. Таким образом, атом серы в молекуле $H_2S$ имеет две общие электронные пары (связи $S-H$) и две неподеленные электронные пары на внешнем слое.
Электронная конфигурация самого атома серы в молекуле сероводорода не изменяется по числу принадлежащих ему электронов, она остается $1s^2 2s^2 2p^6 3s^2 3p^4$. Однако его электронное окружение меняется.
Сравнение: Изолированный атом серы имеет 6 валентных электронов и незавершенный внешний слой. В молекуле сероводорода атом серы использует свои два неспаренных электрона для образования двух ковалентных связей. В результате этого обобществления электронов атом серы в молекуле $H_2S$ достигает стабильного октета (8 электронов) на внешнем слое ($6$ собственных $+ 2$ от двух атомов водорода). В отличие от ионов, атом серы в молекуле остается электронейтральным, хотя и приобретает частичный отрицательный заряд ($\delta^−$) из-за большей электроотрицательности по сравнению с водородом.
Ответ: Свободный атом серы ($S$) имеет конфигурацию $1s^2 2s^2 2p^6 3s^2 3p^4$ с шестью валентными электронами. В молекуле сероводорода ($H_2S$) атом серы не меняет свою основную электронную конфигурацию и число электронов, но образует две ковалентные связи. В результате, его электронная схема изменяется: за счет общих электронных пар с водородом атом серы в молекуле имеет завершенную внешнюю электронную оболочку из 8 электронов, в отличие от 6 валентных электронов у свободного атома.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 4 расположенного на странице 76 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 76), авторов: Мычко (Дмитрий Иванович), Прохоревич (Константин Николаевич), Борушко (Ирина Ивановна), учебного пособия издательства Адукацыя i выхаванне.













