Номер 2, страница 93 - гдз по химии 11 класс учебник Мычко, Прохоревич

Авторы: Мычко Д. И., Прохоревич К. Н., Борушко И. И.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2021 - 2025
Цвет обложки: зелёный с колбами
ISBN: 978-985-599-297-5
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава III. Химическая связь и строение вещества. Параграф 16. Типы кристаллических структур - номер 2, страница 93.
№2 (с. 93)
Условия. №2 (с. 93)
скриншот условия

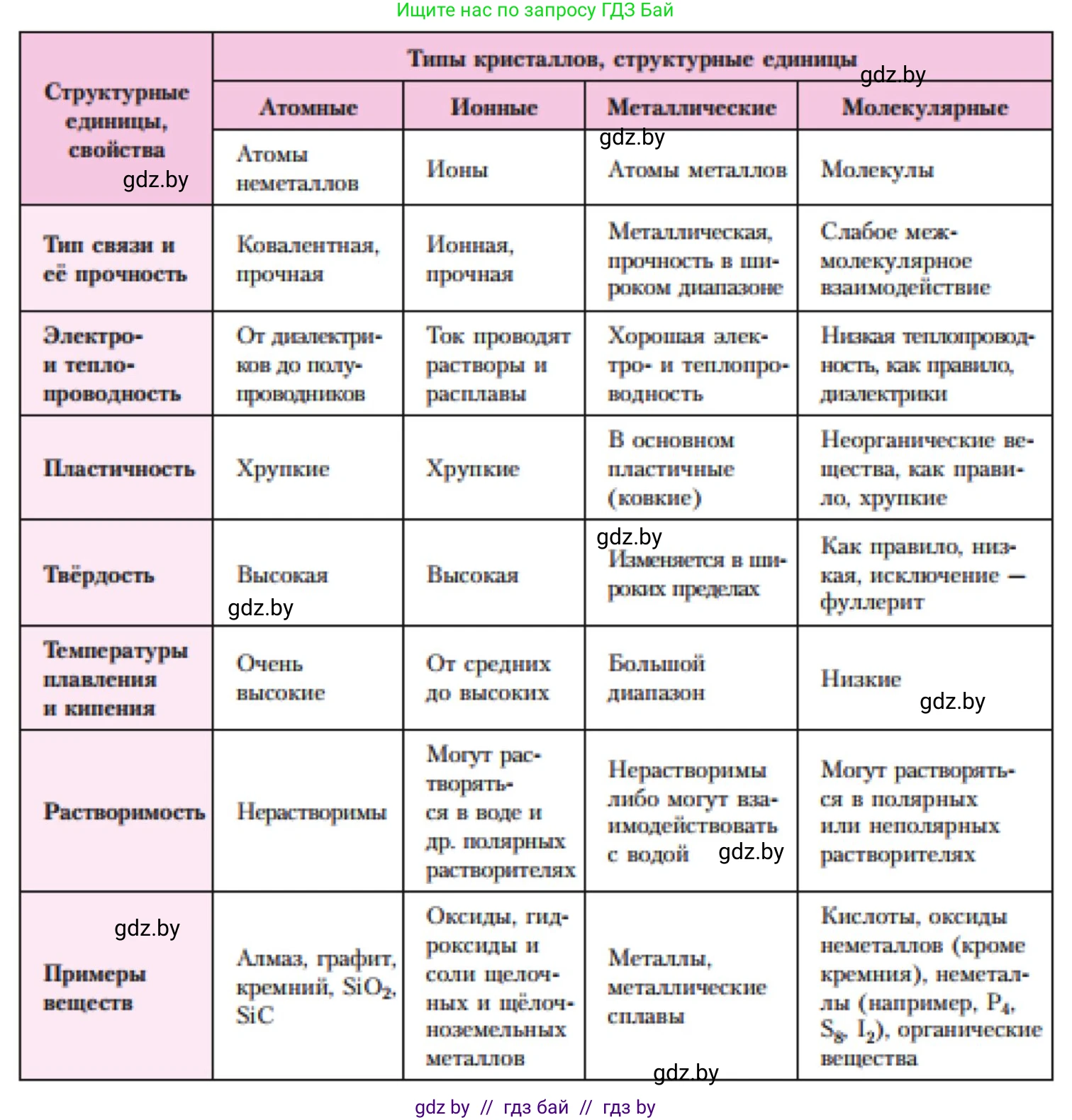
2. Сравните свойства атомных, молекулярных, ионных и металлических кристаллов.
Решение. №2 (с. 93)
Решение 2. №2 (с. 93)
Свойства кристаллов определяются типом частиц, находящихся в узлах кристаллической решетки, и характером химической связи между ними. Рассмотрим четыре основных типа кристаллических решеток.
Атомные кристаллы
В узлах атомных кристаллических решеток находятся отдельные атомы, связанные между собой очень прочными и направленными ковалентными связями. Эти связи образуют единый трехмерный каркас, который пронизывает весь кристалл, по сути, превращая его в одну гигантскую макромолекулу.
Свойства:
1. Твердость и прочность: Атомные кристаллы обладают очень высокой твердостью и прочностью, так как для их разрушения необходимо разорвать прочные ковалентные связи. Алмаз — эталон твердости.
2. Температуры плавления и кипения: Очень высокие. Требуется большое количество энергии для преодоления сил ковалентного связывания. Например, температура плавления алмаза > 3550 °C.
3. Электропроводность: В большинстве случаев являются диэлектриками (алмаз) или полупроводниками (кремний, германий), так как валентные электроны жестко локализованы в ковалентных связях и не могут свободно перемещаться. Исключением является графит, который проводит электрический ток благодаря наличию делокализованных электронов в его слоистой структуре.
4. Растворимость: Практически нерастворимы в каких-либо растворителях.
5. Летучесть: Нелетучи.
Примеры: алмаз (C), графит (C), кремний (Si), оксид кремния(IV) (SiO₂, кварц), карбид кремния (SiC).
Ответ: Атомные кристаллы характеризуются очень высокой твердостью, тугоплавкостью, нерастворимостью и, как правило, низкой электропроводностью из-за прочных ковалентных связей между атомами в решетке.
Молекулярные кристаллы
В узлах молекулярных решеток находятся молекулы (полярные или неполярные). Внутри этих молекул атомы связаны прочными ковалентными связями, но сами молекулы в кристалле удерживаются друг около друга слабыми межмолекулярными силами (силами Ван-дер-Ваальса, водородными связями). Именно эти слабые межмолекулярные силы определяют физические свойства кристалла.
Свойства:
1. Твердость и прочность: Низкая твердость, малая механическая прочность, хрупкость. Межмолекулярные связи легко разрушаются.
2. Температуры плавления и кипения: Низкие. Вещества с молекулярной решеткой плавятся и кипят при невысоких температурах.
3. Электропроводность: Не проводят электрический ток ни в твердом, ни в жидком состоянии (являются диэлектриками), так как в кристалле нет свободных носителей заряда.
4. Растворимость: Растворимость подчиняется правилу "подобное растворяется в подобном". Вещества с неполярными молекулами (йод, нафталин) растворяются в неполярных растворителях, а с полярными (сахар, лед) — в полярных.
5. Летучесть: Многие из них летучи (например, йод, нафталин, сухой лед).
Примеры: лед (H₂O), твердый диоксид углерода ("сухой лед", CO₂), йод (I₂), нафталин (C₁₀H₈), сера (S₈), белый фосфор (P₄), большинство органических соединений.
Ответ: Молекулярные кристаллы характеризуются низкой твердостью, низкими температурами плавления, неэлектропроводностью и часто высокой летучестью из-за слабых межмолекулярных сил между молекулами.
Ионные кристаллы
В узлах ионных решеток находятся чередующиеся положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Они удерживаются вместе за счет сильного электростатического притяжения (ионной связи), которое действует во всех направлениях.
Свойства:
1. Твердость и прочность: Обладают значительной твердостью, но при этом хрупки. При механическом воздействии происходит сдвиг слоев ионов, в результате чего одноименно заряженные ионы оказываются рядом, их взаимное отталкивание приводит к раскалыванию кристалла.
2. Температуры плавления и кипения: Высокие. Для разрушения сильных ионных связей требуется много энергии.
3. Электропроводность: В твердом состоянии являются диэлектриками, так как ионы жестко зафиксированы в узлах решетки. Однако их расплавы и водные растворы хорошо проводят электрический ток, поскольку ионы становятся подвижными и могут переносить заряд.
4. Растворимость: Многие хорошо растворимы в полярных растворителях, таких как вода. Молекулы растворителя сольватируют (окружают) ионы, ослабляя связь между ними.
5. Летучесть: Нелетучи.
Примеры: соли (NaCl, KNO₃, CuSO₄), оксиды активных металлов (MgO, CaO), щелочи (NaOH).
Ответ: Ионные кристаллы — это твердые, но хрупкие, тугоплавкие и нелетучие вещества. Они не проводят ток в твердом виде, но являются проводниками в расплавах и растворах.
Металлические кристаллы
В узлах металлической решетки находятся положительно заряженные ионы металлов. Между ними свободно перемещаются обобществленные валентные электроны, образуя так называемый "электронный газ". Связь между катионами и этим "газом" называется металлической. Эта связь является ненаправленной и неделокализованной.
Свойства:
1. Твердость и прочность: Варьируются в широких пределах — от очень мягких (щелочные металлы, которые можно резать ножом) до очень твердых (хром, вольфрам). Характерной чертой является пластичность (ковкость и тягучесть). При деформации слои ионов могут смещаться друг относительно друга без разрыва связи, так как "электронный газ" мгновенно перераспределяется.
2. Температуры плавления и кипения: Варьируются в очень широком диапазоне (от -39 °C у ртути до 3422 °C у вольфрама).
3. Электропроводность: Обладают высокой электро- и теплопроводностью как в твердом, так и в жидком состоянии благодаря наличию подвижных свободных электронов.
4. Растворимость: Нерастворимы в обычных растворителях, но могут образовывать сплавы с другими металлами или вступать в химические реакции (например, с кислотами).
5. Внешний вид: Имеют характерный металлический блеск, так как "электронный газ" способен отражать световые волны.
Примеры: все металлы (Fe, Cu, Al, Na, W) и их сплавы (сталь, бронза, латунь).
Ответ: Металлические кристаллы характеризуются пластичностью, высокой электро- и теплопроводностью, металлическим блеском. Их твердость и температуры плавления могут сильно различаться.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 2 расположенного на странице 93 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 93), авторов: Мычко (Дмитрий Иванович), Прохоревич (Константин Николаевич), Борушко (Ирина Ивановна), учебного пособия издательства Адукацыя i выхаванне.













