Номер 5, страница 158 - гдз по химии 11 класс учебник Мычко, Прохоревич

Авторы: Мычко Д. И., Прохоревич К. Н., Борушко И. И.
Тип: Учебник
Издательство: Адукацыя i выхаванне
Год издания: 2021 - 2025
Цвет обложки: зелёный с колбами
ISBN: 978-985-599-297-5
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава VI. Неметаллы. Параграф 28. Общая характеристика неметаллов - номер 5, страница 158.
№5 (с. 158)
Условия. №5 (с. 158)
скриншот условия

5. Составьте уравнения реакций с участием неметаллов, учитывая, что атомы неметаллов в заданных реакциях проявляют низшую степень окисления:
$\text{Al} + \text{Cl}_2 \to$; $\text{Li} + \text{N}_2 \to$; $\text{Ca} + \text{P} \to$; $\text{Zn} + \text{Br}_2 \to$; $\text{K} + \text{H}_2 \to$; $\text{Al} + \text{S} \to$.
Решение. №5 (с. 158)
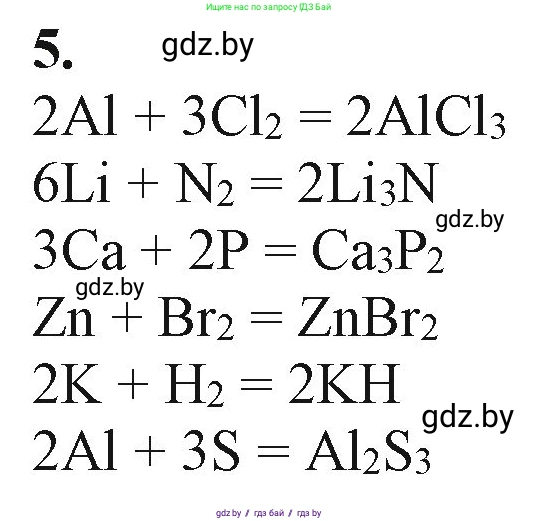
Решение 2. №5 (с. 158)
Al + Cl₂ →
В этой реакции алюминий (Al), как металл III группы главной подгруппы, проявляет свою типичную степень окисления +3. Хлор (Cl₂) – это неметалл-галоген, и его низшая степень окисления равна -1. Продукт реакции — хлорид алюминия. Для составления его формулы используем правило валентности (или степеней окисления): $Al^{+3}Cl^{-1}$. Наименьшее общее кратное для зарядов 3 и 1 равно 3. Таким образом, формула соли — $AlCl_3$.
Теперь составим и уравняем уравнение реакции:
$Al + Cl_2 \rightarrow AlCl_3$
Слева 2 атома хлора, справа 3. Уравняем их, поставив коэффициент 2 перед $AlCl_3$ и 3 перед $Cl_2$.
$Al + 3Cl_2 \rightarrow 2AlCl_3$
Теперь справа 2 атома алюминия, а слева 1. Поставим коэффициент 2 перед Al слева.
Ответ: $2Al + 3Cl_2 \rightarrow 2AlCl_3$
Li + N₂ →
Литий (Li) – щелочной металл I группы, его степень окисления в соединениях +1. Азот (N₂) – неметалл V группы, его низшая степень окисления равна -3. Продукт реакции — нитрид лития. Составляем формулу: $Li^{+1}N^{-3} \rightarrow Li_3N$.
Составим и уравняем уравнение реакции:
$Li + N_2 \rightarrow Li_3N$
Слева 2 атома азота, справа 1. Поставим коэффициент 2 перед $Li_3N$.
$Li + N_2 \rightarrow 2Li_3N$
Теперь справа $2 \times 3 = 6$ атомов лития. Поставим коэффициент 6 перед Li слева.
Ответ: $6Li + N_2 \rightarrow 2Li_3N$
Ca + P →
Кальций (Ca) – щелочноземельный металл II группы, его степень окисления в соединениях +2. Фосфор (P) – неметалл V группы, его низшая степень окисления -3. Продукт реакции — фосфид кальция. Составляем формулу: $Ca^{+2}P^{-3}$. Наименьшее общее кратное для зарядов 2 и 3 равно 6. Формула вещества — $Ca_3P_2$.
Составим и уравняем уравнение реакции:
$Ca + P \rightarrow Ca_3P_2$
Справа 3 атома кальция, поставим коэффициент 3 перед Ca слева. Справа 2 атома фосфора, поставим коэффициент 2 перед P слева.
Ответ: $3Ca + 2P \rightarrow Ca_3P_2$
Zn + Br₂ →
Цинк (Zn) – металл, который в соединениях почти всегда проявляет степень окисления +2. Бром (Br₂) – неметалл-галоген, его низшая степень окисления -1. Продукт реакции — бромид цинка. Составляем формулу: $Zn^{+2}Br^{-1} \rightarrow ZnBr_2$.
Составим уравнение реакции:
$Zn + Br_2 \rightarrow ZnBr_2$
Проверим количество атомов: слева 1 атом цинка и 2 атома брома; справа 1 атом цинка и 2 атома брома. Реакция уравнена.
Ответ: $Zn + Br_2 \rightarrow ZnBr_2$
K + H₂ →
Калий (K) – щелочной металл I группы, его степень окисления в соединениях +1. Водород (H₂) в реакциях с активными металлами выступает в роли окислителя и проявляет свою низшую степень окисления -1, образуя гидриды. Продукт реакции — гидрид калия. Составляем формулу: $K^{+1}H^{-1} \rightarrow KH$.
Составим и уравняем уравнение реакции:
$K + H_2 \rightarrow KH$
Слева 2 атома водорода, справа 1. Поставим коэффициент 2 перед $KH$.
$K + H_2 \rightarrow 2KH$
Теперь справа 2 атома калия. Поставим коэффициент 2 перед K слева.
Ответ: $2K + H_2 \rightarrow 2KH$
Al + S →
Алюминий (Al) – металл III группы, степень окисления +3. Сера (S) – неметалл VI группы, её низшая степень окисления -2. Продукт реакции — сульфид алюминия. Составляем формулу: $Al^{+3}S^{-2}$. Наименьшее общее кратное для зарядов 3 и 2 равно 6. Формула вещества — $Al_2S_3$.
Составим и уравняем уравнение реакции:
$Al + S \rightarrow Al_2S_3$
Справа 2 атома алюминия, поставим коэффициент 2 перед Al слева. Справа 3 атома серы, поставим коэффициент 3 перед S слева.
Ответ: $2Al + 3S \rightarrow Al_2S_3$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 5 расположенного на странице 158 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 158), авторов: Мычко (Дмитрий Иванович), Прохоревич (Константин Николаевич), Борушко (Ирина Ивановна), учебного пособия издательства Адукацыя i выхаванне.













