Номер 699, страница 121 - гдз по химии 8 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2019 - 2025
Цвет обложки: голубой, зелёный с кристаллами
ISBN: 978-985-599-064-3
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 8 классе
Глава VI. Растворы. Параграф 47. Растворение веществ в воде - номер 699, страница 121.
№699 (с. 121)
Условие. №699 (с. 121)
скриншот условия

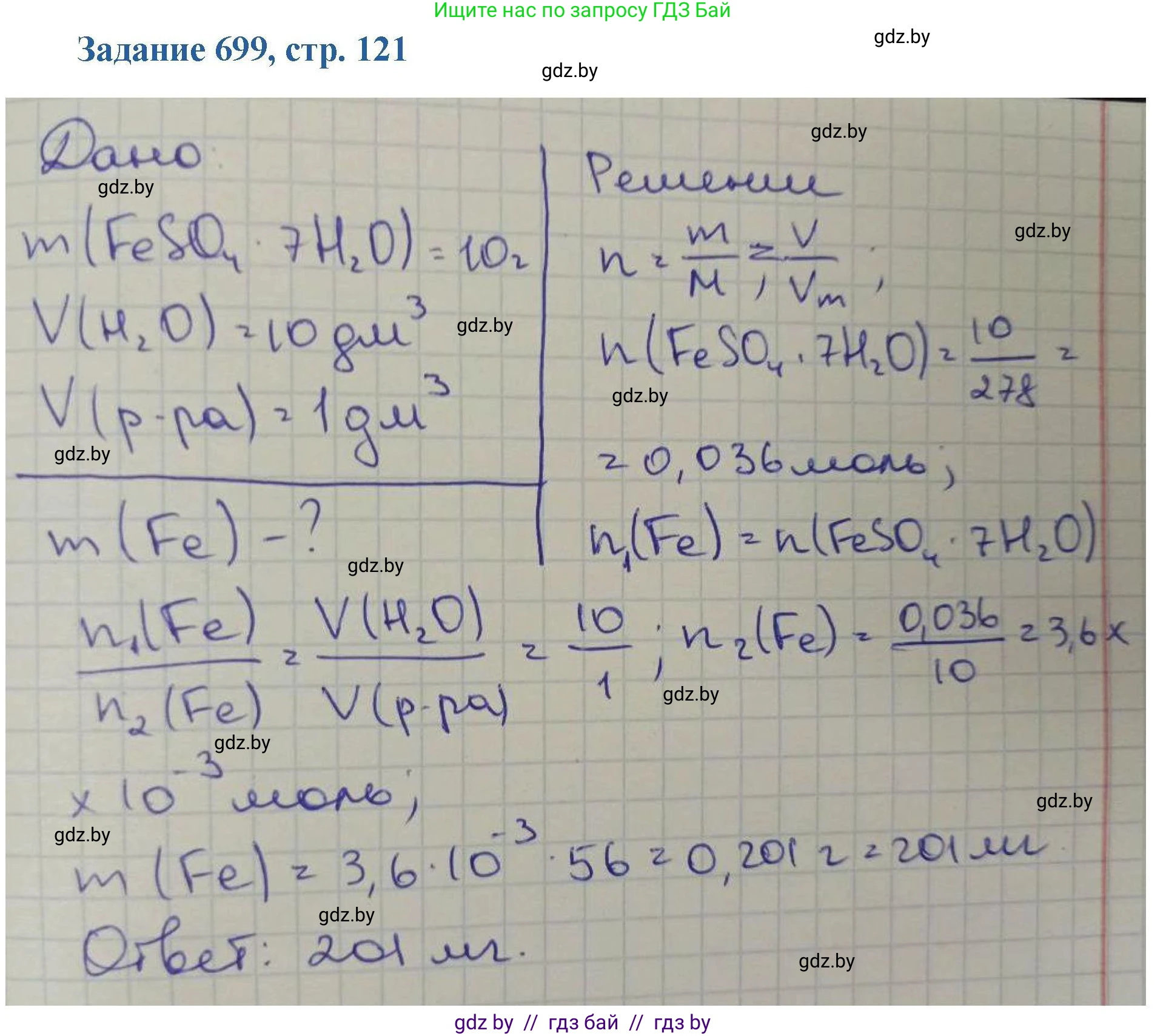
699. Железный купорос применяется для подкормки цветочных, декоративных, плодово-ягодных и других культур с целью профилактики и лечения растений от заболеваний. При недостатке железа наблюдается недоразвитость листьев, слабый прирост побегов, неполное развитие плодов и снижение урожайности. У плодовых деревьев признаки недостатка железа наиболее выражены после распускания листьев. Раствор для подкормки растений готовят растворением 10,0 г железного купороса в $10,0\ \text{дм}^3$ воды. Железо какой массой содержится в $1,00\ \text{дм}^3$ такого раствора?
Решение. №699 (с. 121)
Решение 2. №699 (с. 121)
Дано:
Масса железного купороса в исходном растворе: $m_{общ}(FeSO_4 \cdot 7H_2O) = 10,0 \text{ г}$
Объем исходного раствора: $V_1 = 10,0 \text{ дм}^3$
Объем, для которого нужно рассчитать массу железа: $V_2 = 1,00 \text{ дм}^3$
Найти:
Массу железа в $1,00 \text{ дм}^3$ раствора: $m(Fe) - ?$
Решение:
1. Сначала определим массу железного купороса, которая содержится в $1,00 \text{ дм}^3$ раствора. Поскольку раствор однороден, можно составить пропорцию:
в $10,0 \text{ дм}^3$ раствора содержится $10,0 \text{ г}$ железного купороса.
в $1,00 \text{ дм}^3$ раствора содержится $m_x \text{ г}$ железного купороса.
$m_x = \frac{10,0 \text{ г} \times 1,00 \text{ дм}^3}{10,0 \text{ дм}^3} = 1,00 \text{ г}$
Таким образом, в $1,00 \text{ дм}^3$ раствора содержится $1,00 \text{ г}$ железного купороса.
2. Железный купорос — это кристаллогидрат сульфата железа(II), его химическая формула $FeSO_4 \cdot 7H_2O$. Чтобы найти массу чистого железа (Fe) в этом количестве вещества, рассчитаем массовую долю железа в составе железного купороса.
Для этого найдем молярную массу $FeSO_4 \cdot 7H_2O$, используя относительные атомные массы элементов (округлим до целых для удобства): $Ar(Fe) = 56$, $Ar(S) = 32$, $Ar(O) = 16$, $Ar(H) = 1$.
$M(FeSO_4 \cdot 7H_2O) = Ar(Fe) + Ar(S) + 4 \cdot Ar(O) + 7 \cdot (2 \cdot Ar(H) + Ar(O))$
$M(FeSO_4 \cdot 7H_2O) = 56 + 32 + 4 \cdot 16 + 7 \cdot (2 \cdot 1 + 16) = 88 + 64 + 7 \cdot 18 = 152 + 126 = 278 \text{ г/моль}$
3. Теперь рассчитаем массовую долю железа $\omega(Fe)$ в соединении:
$\omega(Fe) = \frac{Ar(Fe)}{M(FeSO_4 \cdot 7H_2O)} = \frac{56}{278}$
4. Наконец, найдем массу железа в $1,00 \text{ г}$ железного купороса, умножив массу вещества на массовую долю элемента:
$m(Fe) = m_x \times \omega(Fe) = 1,00 \text{ г} \times \frac{56}{278} \approx 0,20143... \text{ г}$
Округляя результат до трех значащих цифр (в соответствии с данными задачи $10,0$; $10,0$; $1,00$), получаем $0,201 \text{ г}$.
Ответ: в $1,00 \text{ дм}^3$ такого раствора содержится $0,201 \text{ г}$ железа.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 699 расположенного на странице 121 к сборнику задач 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №699 (с. 121), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.













