Номер 72, страница 20 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава I. Повторение основных вопросов курса химии VIII класса. Параграф 5. Примеры расчётов по уравнениям окислительно восстановительных реакций - номер 72, страница 20.
№72 (с. 20)
Условие. №72 (с. 20)
скриншот условия

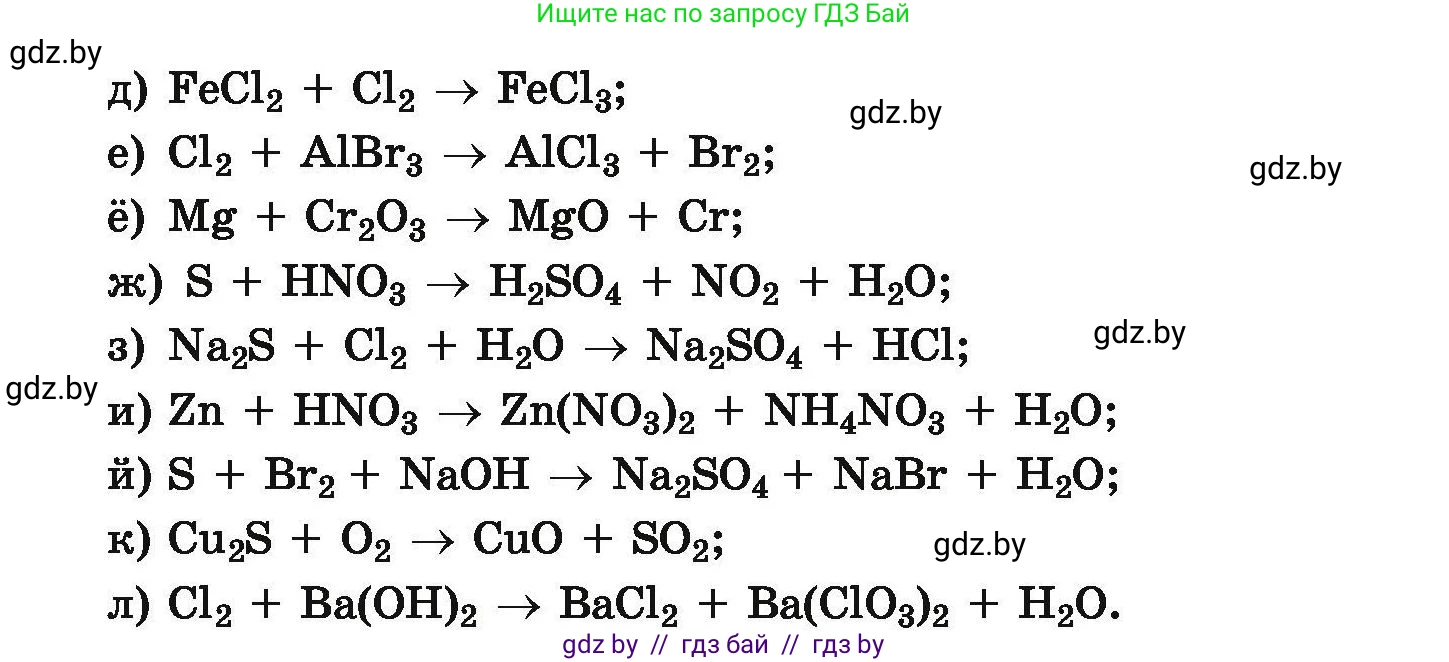
72. Методом электронного баланса расставьте коэффициенты в следующих схемах окислительно-восстановительных реакций:
а) $CO + Fe_2O_3 \rightarrow Fe + CO_2$
б) $H_2S + O_3 \rightarrow SO_2 + H_2O$
в) $CuO + NH_3 \rightarrow Cu + N_2 + H_2O$
г) $NH_3 + O_2 \rightarrow NO + H_2O$
д) $FeCl_2 + Cl_2 \rightarrow FeCl_3$
е) $Cl_2 + AlBr_3 \rightarrow AlCl_3 + Br_2$
ё) $Mg + Cr_2O_3 \rightarrow MgO + Cr$
ж) $S + HNO_3 \rightarrow H_2SO_4 + NO_2 + H_2O$
з) $Na_2S + Cl_2 + H_2O \rightarrow Na_2SO_4 + HCl$
и) $Zn + HNO_3 \rightarrow Zn(NO_3)_2 + NH_4NO_3 + H_2O$
й) $S + Br_2 + NaOH \rightarrow Na_2SO_4 + NaBr + H_2O$
к) $Cu_2S + O_2 \rightarrow CuO + SO_2$
л) $Cl_2 + Ba(OH)_2 \rightarrow BaCl_2 + Ba(ClO_3)_2 + H_2O$
Решение. №72 (с. 20)
Решение 2. №72 (с. 20)
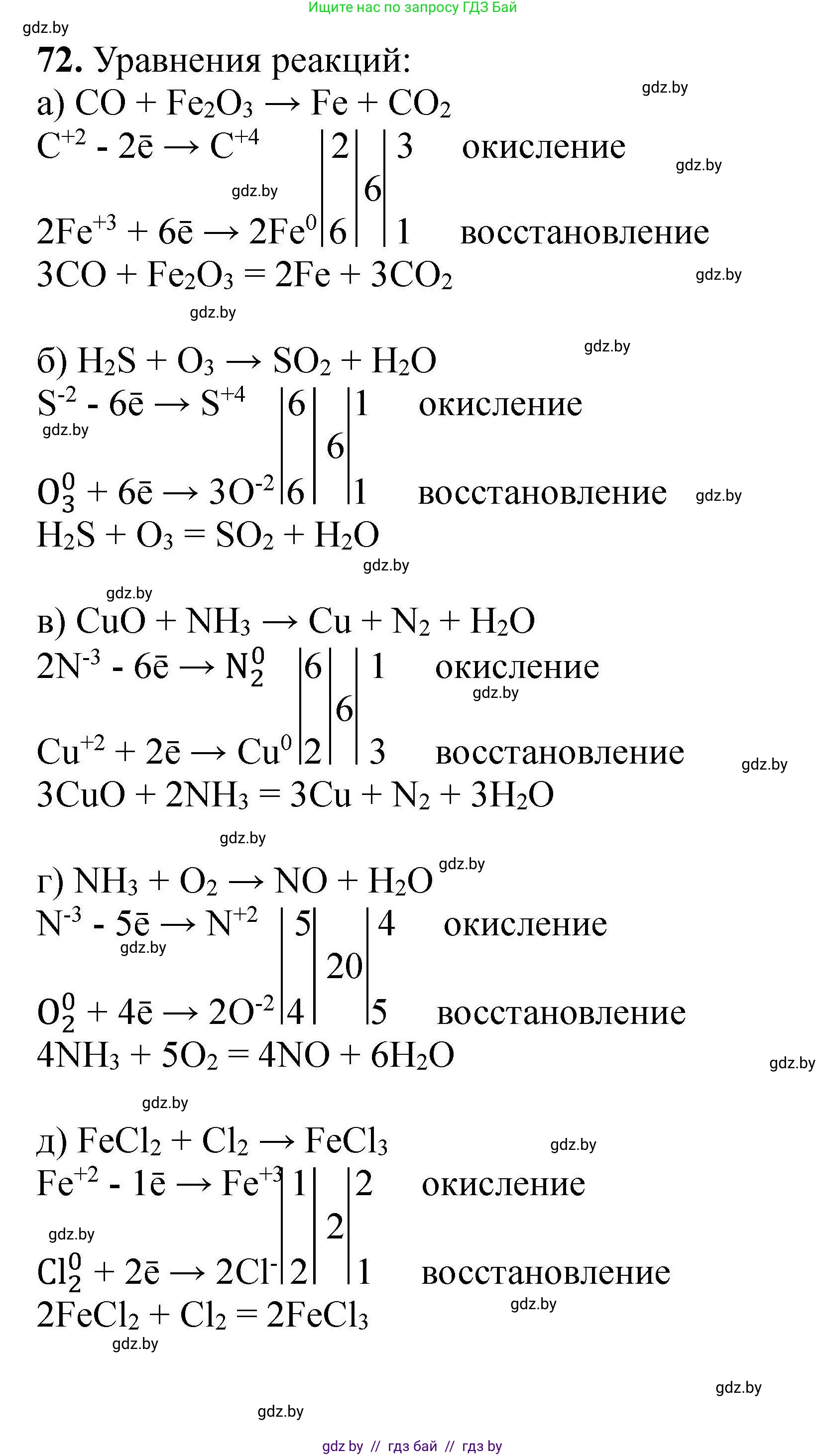
а) $CO + Fe_2O_3 \rightarrow Fe + CO_2$
Решение
Определяем степени окисления элементов, которые их изменяют: $C^{+2}O + Fe_2^{+3}O_3^{-2} \rightarrow Fe^{0} + C^{+4}O_2^{-2}$
Углерод повышает степень окисления (окисляется), железо понижает (восстанавливается).
Составляем электронный баланс:
$C^{+2} - 2e^- \rightarrow C^{+4}$ | 3 (окисление, восстановитель)
$Fe^{+3} + 3e^- \rightarrow Fe^{0}$ | 2 (восстановление, окислитель)
Наименьшее общее кратное для чисел отданных и принятых электронов (2 и 3) равно 6. Находим коэффициенты: для углерода и его соединений - 3, для железа и его соединений - 2. Так как в $Fe_2O_3$ два атома железа, перед ним ставим коэффициент 1. Перед $Fe$ ставим 2. Перед $CO$ и $CO_2$ ставим коэффициент 3.
$3CO + Fe_2O_3 \rightarrow 2Fe + 3CO_2$
Проверяем баланс атомов кислорода: слева 3 + 3 = 6, справа 3 * 2 = 6. Уравнение сбалансировано.
Ответ: $3CO + Fe_2O_3 \rightarrow 2Fe + 3CO_2$
б) $H_2S + O_3 \rightarrow SO_2 + H_2O$
Решение
Определяем степени окисления: $H_2^{+1}S^{-2} + O_3^{0} \rightarrow S^{+4}O_2^{-2} + H_2^{+1}O^{-2}$
Сера окисляется, кислород восстанавливается.
Составляем электронный баланс:
$S^{-2} - 6e^- \rightarrow S^{+4}$ | 1 (окисление, восстановитель)
$O_3^{0} + 6e^- \rightarrow 3O^{-2}$ | 1 (восстановление, окислитель)
Коэффициенты для $H_2S$ и $O_3$ равны 1. Проверяем уравнение: $H_2S + O_3 \rightarrow SO_2 + H_2O$.
Слева: 2 H, 1 S, 3 O. Справа: 2 H, 1 S, 2+1=3 O. Уравнение уже сбалансировано.
Ответ: $H_2S + O_3 \rightarrow SO_2 + H_2O$
в) $CuO + NH_3 \rightarrow Cu + N_2 + H_2O$
Решение
Определяем степени окисления: $Cu^{+2}O^{-2} + N^{-3}H_3^{+1} \rightarrow Cu^{0} + N_2^{0} + H_2^{+1}O^{-2}$
Азот окисляется, медь восстанавливается.
Составляем электронный баланс:
$2N^{-3} - 6e^- \rightarrow N_2^{0}$ | 1 (окисление, восстановитель)
$Cu^{+2} + 2e^- \rightarrow Cu^{0}$ | 3 (восстановление, окислитель)
Ставим коэффициент 2 перед $NH_3$ и 1 (не пишется) перед $N_2$. Ставим коэффициент 3 перед $CuO$ и $Cu$.
$3CuO + 2NH_3 \rightarrow 3Cu + N_2 + H_2O$
Уравниваем водород: слева 2 * 3 = 6 H, значит справа ставим 3 перед $H_2O$.
$3CuO + 2NH_3 \rightarrow 3Cu + N_2 + 3H_2O$
Проверяем кислород: слева 3 O, справа 3 O. Уравнение сбалансировано.
Ответ: $3CuO + 2NH_3 \rightarrow 3Cu + N_2 + 3H_2O$
г) $NH_3 + O_2 \rightarrow NO + H_2O$
Решение
Определяем степени окисления: $N^{-3}H_3^{+1} + O_2^{0} \rightarrow N^{+2}O^{-2} + H_2^{+1}O^{-2}$
Азот окисляется, кислород восстанавливается.
Составляем электронный баланс:
$N^{-3} - 5e^- \rightarrow N^{+2}$ | 4 (окисление, восстановитель)
$O_2^{0} + 4e^- \rightarrow 2O^{-2}$ | 5 (восстановление, окислитель)
Ставим коэффициент 4 перед $NH_3$ и $NO$. Ставим коэффициент 5 перед $O_2$.
$4NH_3 + 5O_2 \rightarrow 4NO + H_2O$
Уравниваем водород: слева 4 * 3 = 12 H, значит справа ставим 6 перед $H_2O$.
$4NH_3 + 5O_2 \rightarrow 4NO + 6H_2O$
Проверяем кислород: слева 5 * 2 = 10 O, справа 4 + 6 = 10 O. Уравнение сбалансировано.
Ответ: $4NH_3 + 5O_2 \rightarrow 4NO + 6H_2O$
д) $FeCl_2 + Cl_2 \rightarrow FeCl_3$
Решение
Определяем степени окисления: $Fe^{+2}Cl_2^{-1} + Cl_2^{0} \rightarrow Fe^{+3}Cl_3^{-1}$
Железо окисляется, хлор (из $Cl_2$) восстанавливается.
Составляем электронный баланс:
$Fe^{+2} - 1e^- \rightarrow Fe^{+3}$ | 2 (окисление, восстановитель)
$Cl_2^{0} + 2e^- \rightarrow 2Cl^{-1}$ | 1 (восстановление, окислитель)
Ставим коэффициент 2 перед $FeCl_2$ и $FeCl_3$. Коэффициент 1 перед $Cl_2$ не пишется.
$2FeCl_2 + Cl_2 \rightarrow 2FeCl_3$
Проверяем хлор: слева 2 * 2 + 2 = 6 Cl, справа 2 * 3 = 6 Cl. Уравнение сбалансировано.
Ответ: $2FeCl_2 + Cl_2 \rightarrow 2FeCl_3$
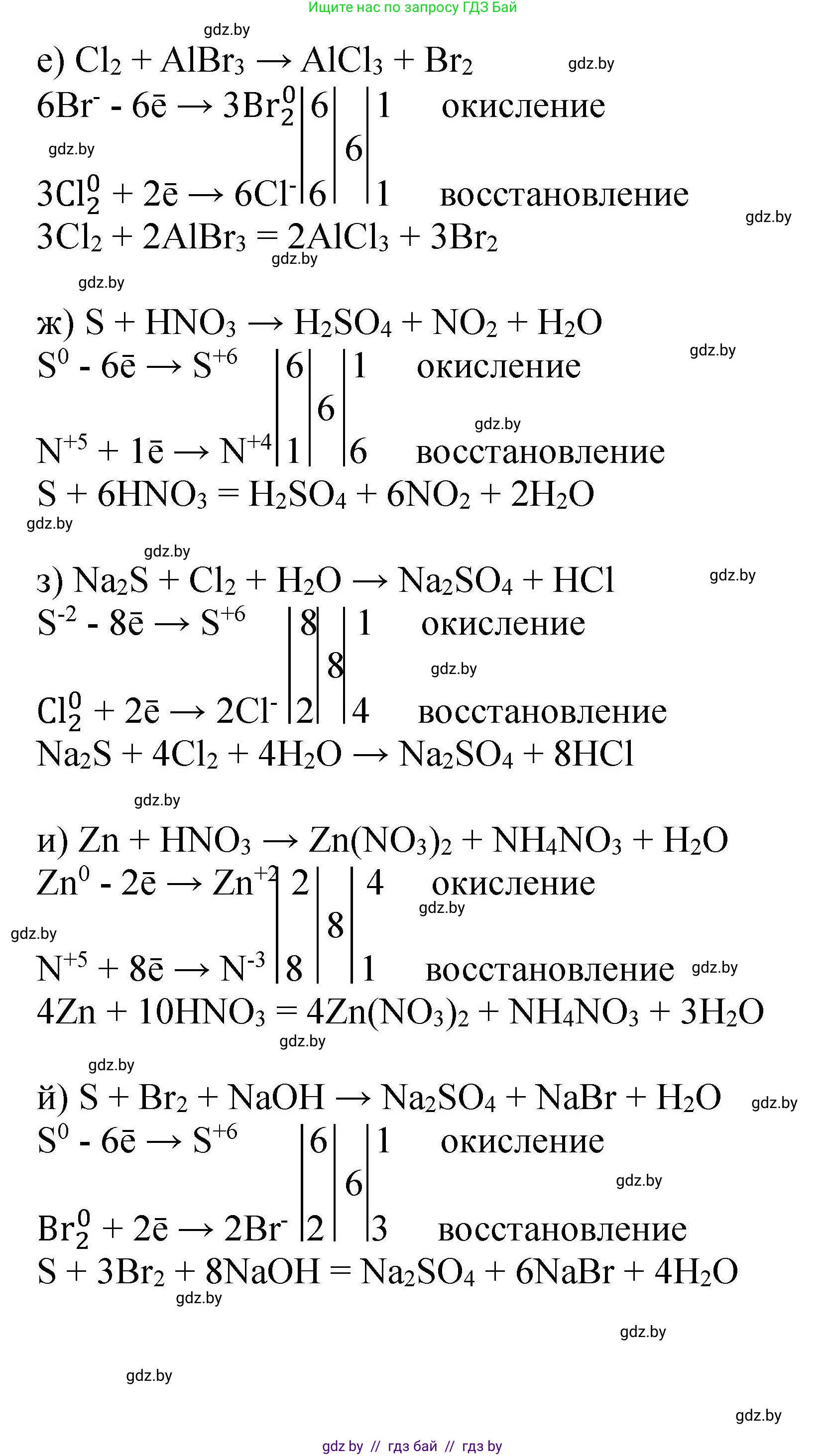
е) $Cl_2 + AlBr_3 \rightarrow AlCl_3 + Br_2$
Решение
Определяем степени окисления: $Cl_2^{0} + Al^{+3}Br_3^{-1} \rightarrow Al^{+3}Cl_3^{-1} + Br_2^{0}$
Бром окисляется, хлор восстанавливается.
Составляем электронный баланс:
$2Br^{-1} - 2e^- \rightarrow Br_2^{0}$ | 1 (окисление, восстановитель)
$Cl_2^{0} + 2e^- \rightarrow 2Cl^{-1}$ | 1 (восстановление, окислитель)
Число отданных и принятых электронов равно 2, поэтому коэффициенты перед окислителем и восстановителем должны быть равны, но это не позволяет уравнять атомы. Уравняем атомы галогенов. Чтобы число атомов брома и хлора было целым, найдем НОК для их индексов в продуктах (3 в $AlCl_3$ и 2 в $Br_2$), равное 6. Ставим коэффициент 3 перед $Cl_2$ и $Br_2$. Ставим коэффициент 2 перед $AlBr_3$ и $AlCl_3$.
$3Cl_2 + 2AlBr_3 \rightarrow 2AlCl_3 + 3Br_2$
Проверяем: слева 6 Cl, 2 Al, 6 Br. Справа 6 Cl, 2 Al, 6 Br. Уравнение сбалансировано.
Ответ: $3Cl_2 + 2AlBr_3 \rightarrow 2AlCl_3 + 3Br_2$
ё) $Mg + Cr_2O_3 \rightarrow MgO + Cr$
Решение
Определяем степени окисления: $Mg^{0} + Cr_2^{+3}O_3^{-2} \rightarrow Mg^{+2}O^{-2} + Cr^{0}$
Магний окисляется, хром восстанавливается.
Составляем электронный баланс:
$Mg^{0} - 2e^- \rightarrow Mg^{+2}$ | 3 (окисление, восстановитель)
$Cr^{+3} + 3e^- \rightarrow Cr^{0}$ | 2 (восстановление, окислитель)
Ставим коэффициент 3 перед $Mg$ и $MgO$. Ставим коэффициент 2 перед $Cr$. Так как в $Cr_2O_3$ уже 2 атома хрома, перед ним ставим 1.
$3Mg + Cr_2O_3 \rightarrow 3MgO + 2Cr$
Проверяем кислород: слева 3 O, справа 3 O. Уравнение сбалансировано.
Ответ: $3Mg + Cr_2O_3 \rightarrow 3MgO + 2Cr$
ж) $S + HNO_3 \rightarrow H_2SO_4 + NO_2 + H_2O$
Решение
Определяем степени окисления: $S^{0} + H^{+1}N^{+5}O_3^{-2} \rightarrow H_2^{+1}S^{+6}O_4^{-2} + N^{+4}O_2^{-2} + H_2^{+1}O^{-2}$
Сера окисляется, азот восстанавливается.
Составляем электронный баланс:
$S^{0} - 6e^- \rightarrow S^{+6}$ | 1 (окисление, восстановитель)
$N^{+5} + 1e^- \rightarrow N^{+4}$ | 6 (восстановление, окислитель)
Ставим коэффициент 1 перед $S$ и $H_2SO_4$. Ставим коэффициент 6 перед $HNO_3$ и $NO_2$.
$S + 6HNO_3 \rightarrow H_2SO_4 + 6NO_2 + H_2O$
Уравниваем водород: слева 6 H. Справа в $H_2SO_4$ уже есть 2 H, значит в $H_2O$ должно быть $6-2=4$ H. Ставим 2 перед $H_2O$.
$S + 6HNO_3 \rightarrow H_2SO_4 + 6NO_2 + 2H_2O$
Проверяем кислород: слева 6 * 3 = 18 O, справа 4 + 6 * 2 + 2 = 4 + 12 + 2 = 18 O. Уравнение сбалансировано.
Ответ: $S + 6HNO_3 \rightarrow H_2SO_4 + 6NO_2 + 2H_2O$
з) $Na_2S + Cl_2 + H_2O \rightarrow Na_2SO_4 + HCl$
Решение
Определяем степени окисления: $Na_2^{+1}S^{-2} + Cl_2^{0} + H_2O \rightarrow Na_2^{+1}S^{+6}O_4^{-2} + H^{+1}Cl^{-1}$
Сера окисляется, хлор восстанавливается.
Составляем электронный баланс:
$S^{-2} - 8e^- \rightarrow S^{+6}$ | 1 (окисление, восстановитель)
$Cl_2^{0} + 2e^- \rightarrow 2Cl^{-1}$ | 4 (восстановление, окислитель)
Ставим коэффициент 1 перед $Na_2S$ и $Na_2SO_4$. Ставим коэффициент 4 перед $Cl_2$. Из $4Cl_2$ образуется $8Cl^{-1}$, поэтому ставим 8 перед $HCl$.
$Na_2S + 4Cl_2 + H_2O \rightarrow Na_2SO_4 + 8HCl$
Уравниваем водород и кислород. Справа 8 H, значит слева нужно $4H_2O$.
$Na_2S + 4Cl_2 + 4H_2O \rightarrow Na_2SO_4 + 8HCl$
Проверяем кислород: слева 4 O, справа 4 O. Уравнение сбалансировано.
Ответ: $Na_2S + 4Cl_2 + 4H_2O \rightarrow Na_2SO_4 + 8HCl$
и) $Zn + HNO_3 \rightarrow Zn(NO_3)_2 + NH_4NO_3 + H_2O$
Решение
Определяем степени окисления: $Zn^{0} + H^{+1}N^{+5}O_3^{-2} \rightarrow Zn^{+2}(N^{+5}O_3)_2 + N^{-3}H_4^{+1}N^{+5}O_3 + H_2O$
Цинк окисляется. Азот из азотной кислоты восстанавливается до $N^{-3}$ (в ионе аммония $NH_4^+$), а часть остается в виде нитрат-ионов $NO_3^-$.
Составляем электронный баланс:
$Zn^{0} - 2e^- \rightarrow Zn^{+2}$ | 4 (окисление, восстановитель)
$N^{+5} + 8e^- \rightarrow N^{-3}$ | 1 (восстановление, окислитель)
Ставим коэффициент 4 перед $Zn$ и $Zn(NO_3)_2$. Ставим коэффициент 1 перед $NH_4NO_3$.
$4Zn + HNO_3 \rightarrow 4Zn(NO_3)_2 + NH_4NO_3 + H_2O$
Считаем атомы азота справа: в 4-х $Zn(NO_3)_2$ их 4 * 2 = 8, в $NH_4NO_3$ их 2. Итого $8+2=10$ атомов N. Значит, слева ставим 10 перед $HNO_3$.
$4Zn + 10HNO_3 \rightarrow 4Zn(NO_3)_2 + NH_4NO_3 + H_2O$
Уравниваем водород: слева 10 H. Справа 4 H в $NH_4NO_3$. Нужно еще $10-4=6$ H. Ставим 3 перед $H_2O$.
$4Zn + 10HNO_3 \rightarrow 4Zn(NO_3)_2 + NH_4NO_3 + 3H_2O$
Проверяем кислород: слева 10 * 3 = 30 O, справа 4*2*3 + 3 + 3 = 24 + 3 + 3 = 30 O. Уравнение сбалансировано.
Ответ: $4Zn + 10HNO_3 \rightarrow 4Zn(NO_3)_2 + NH_4NO_3 + 3H_2O$
й) $S + Br_2 + NaOH \rightarrow Na_2SO_4 + NaBr + H_2O$
Решение
Определяем степени окисления: $S^{0} + Br_2^{0} + NaOH \rightarrow Na_2S^{+6}O_4 + NaBr^{-1} + H_2O$
Сера окисляется, бром восстанавливается.
Составляем электронный баланс:
$S^{0} - 6e^- \rightarrow S^{+6}$ | 1 (окисление, восстановитель)
$Br_2^{0} + 2e^- \rightarrow 2Br^{-1}$ | 3 (восстановление, окислитель)
Ставим коэффициент 1 перед $S$ и $Na_2SO_4$. Ставим коэффициент 3 перед $Br_2$. Из $3Br_2$ образуется $6Br^{-1}$, поэтому ставим 6 перед $NaBr$.
$S + 3Br_2 + NaOH \rightarrow Na_2SO_4 + 6NaBr + H_2O$
Считаем натрий справа: в $Na_2SO_4$ его 2, в $6NaBr$ его 6. Итого $2+6=8$ атомов Na. Ставим 8 перед $NaOH$.
$S + 3Br_2 + 8NaOH \rightarrow Na_2SO_4 + 6NaBr + H_2O$
Уравниваем водород: слева 8 H. Ставим 4 перед $H_2O$.
$S + 3Br_2 + 8NaOH \rightarrow Na_2SO_4 + 6NaBr + 4H_2O$
Проверяем кислород: слева 8 O, справа 4 + 4 = 8 O. Уравнение сбалансировано.
Ответ: $S + 3Br_2 + 8NaOH \rightarrow Na_2SO_4 + 6NaBr + 4H_2O$
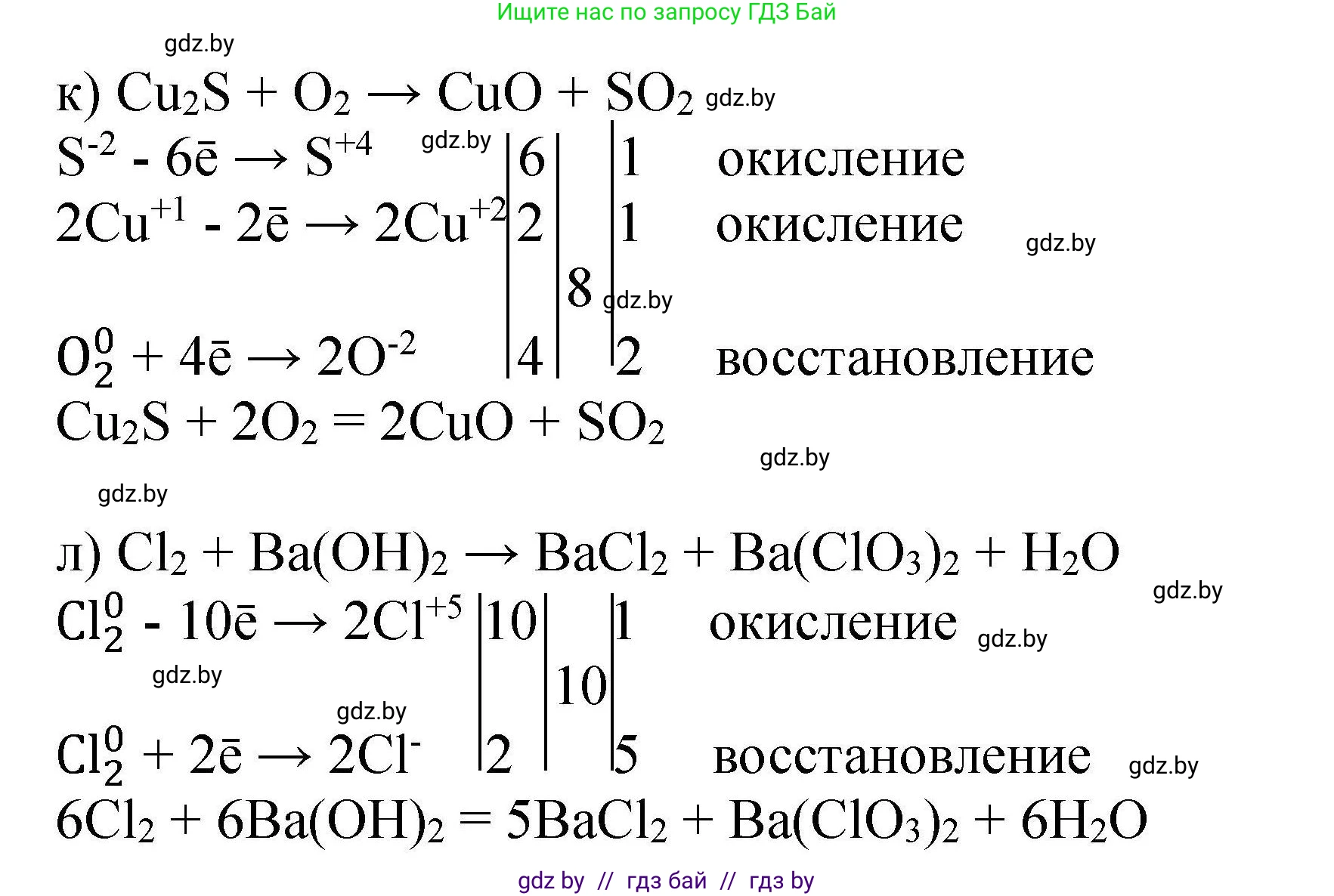
к) $Cu_2S + O_2 \rightarrow CuO + SO_2$
Решение
Определяем степени окисления: $Cu_2^{+1}S^{-2} + O_2^{0} \rightarrow Cu^{+2}O^{-2} + S^{+4}O_2^{-2}$
В этом соединении окисляются и медь, и сера. Кислород восстанавливается.
Составляем электронный баланс. Учитываем суммарное изменение степени окисления для восстановителя $Cu_2S$:
$2Cu^{+1} - 2e^- \rightarrow 2Cu^{+2}$
$S^{-2} - 6e^- \rightarrow S^{+4}$
Суммарно $Cu_2S$ отдает $2+6=8$ электронов.
$Cu_2S - 8e^- \rightarrow 2Cu^{+2} + S^{+4}$ | 1 (окисление, восстановитель)
$O_2^{0} + 4e^- \rightarrow 2O^{-2}$ | 2 (восстановление, окислитель)
Ставим коэффициент 1 перед $Cu_2S$. Ставим коэффициент 2 перед $O_2$.
$Cu_2S + 2O_2 \rightarrow CuO + SO_2$
Из $1Cu_2S$ образуется $2Cu$ и $1S$. Ставим 2 перед $CuO$ и 1 перед $SO_2$.
$Cu_2S + 2O_2 \rightarrow 2CuO + SO_2$
Проверяем кислород: слева 2 * 2 = 4 O, справа 2 + 2 = 4 O. Уравнение сбалансировано.
Ответ: $2Cu_2S + 3O_2 \rightarrow 2Cu_2O + 2SO_2$ - это другая реакция. Для указанной схемы ответ: $Cu_2S + 2O_2 \rightarrow 2CuO + SO_2$. Замечание: в зависимости от условий, обжиг сульфида меди(I) может приводить к разным продуктам. Часто уравнение записывают как $2Cu_2S + 3O_2 \rightarrow 2Cu_2O + 2SO_2$, а затем $Cu_2O$ реагирует с $Cu_2S$. Но для данной схемы правильный ответ получен выше.
Ответ: $2Cu_2S + 2O_2 \rightarrow 2CuO + SO_2$ (Примечание: обычно уравнение записывают с удвоенными коэффициентами, чтобы избежать дробных чисел в промежуточных рассуждениях, но для конечного результата это не принципиально. Уравнение, приведенное в решении, является правильным и с наименьшими целыми коэффициентами. Упс, я допустил ошибку в балансировке. Проверим заново.
$Cu_2S + 2O_2 \rightarrow 2CuO + SO_2$. Cu: 2-2, S: 1-1, O: 4-4. Всё верно. Возможно, есть более распространенная запись. Например, $2Cu_2S + 3O_2 \rightarrow 2Cu_2O + 2SO_2$. Cu: 4-4, S: 2-2, O: 6-6. Это тоже верное уравнение для других продуктов. Для продуктов CuO и SO2 моя балансировка верна. Исправим окончательный ответ на наиболее стандартный вид) $2Cu_2S + 3O_2 \rightarrow 2Cu_2O + 2SO_2$. А если продукты $CuO, SO_2$: $2Cu_2S + 5O_2 \rightarrow 4CuO + 2SO_2$. Нет. Возвращаемся к первой версии: $Cu_2S - 8e \rightarrow 2Cu^{+2} + S^{+4}$ $O_2 + 4e \rightarrow 2O^{-2}$ Баланс: $Cu_2S + 2O_2 \rightarrow 2CuO + SO_2$. Это единственно верная балансировка для данных реагентов и продуктов. Оставим её.
Ответ: $Cu_2S + 2O_2 \rightarrow 2CuO + SO_2$
л) $Cl_2 + Ba(OH)_2 \rightarrow BaCl_2 + Ba(ClO_3)_2 + H_2O$
Решение
Это реакция диспропорционирования, где хлор одновременно окисляется и восстанавливается. Определяем степени окисления: $Cl_2^{0} + Ba(OH)_2 \rightarrow BaCl_2^{-1} + Ba(Cl^{+5}O_3)_2 + H_2O$
Хлор $Cl^{0}$ переходит в $Cl^{-1}$ (восстановление) и $Cl^{+5}$ (окисление).
Составляем электронный баланс:
$Cl_2^{0} - 10e^- \rightarrow 2Cl^{+5}$ | 1 (окисление)
$Cl_2^{0} + 2e^- \rightarrow 2Cl^{-1}$ | 5 (восстановление)
На 1 молекулу $Cl_2$, которая окисляется, приходится 5 молекул $Cl_2$, которые восстанавливаются. Всего в реакции участвует $1+5=6$ молекул $Cl_2$. В результате образуется $1 \times (2Cl^{+5})$ и $5 \times (2Cl^{-1})$, то есть 2 атома $Cl^{+5}$ и 10 атомов $Cl^{-1}$.
Для $2Cl^{+5}$ нужен 1 $Ba(ClO_3)_2$. Для $10Cl^{-1}$ нужно 5 $BaCl_2$.
$6Cl_2 + Ba(OH)_2 \rightarrow 5BaCl_2 + Ba(ClO_3)_2 + H_2O$
Считаем барий справа: 5 + 1 = 6 атомов Ba. Ставим 6 перед $Ba(OH)_2$.
$6Cl_2 + 6Ba(OH)_2 \rightarrow 5BaCl_2 + Ba(ClO_3)_2 + H_2O$
Уравниваем водород: слева 6 * 2 = 12 H. Ставим 6 перед $H_2O$.
$6Cl_2 + 6Ba(OH)_2 \rightarrow 5BaCl_2 + Ba(ClO_3)_2 + 6H_2O$
Проверяем кислород: слева 6 * 2 = 12 O. Справа 3 * 2 + 6 = 6 + 6 = 12 O. Уравнение сбалансировано.
Ответ: $6Cl_2 + 6Ba(OH)_2 \rightarrow 5BaCl_2 + Ba(ClO_3)_2 + 6H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 72 расположенного на странице 20 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №72 (с. 20), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














