Номер 241, страница 42 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 2. Строение атома и периодический закон. Параграф 9. Состояние электрона в атоме - номер 241, страница 42.
№241 (с. 42)
Условие. №241 (с. 42)
скриншот условия

241. *Образец сплава железа-56 и меди-63 содержит электроны и нейтроны химическим количеством 5,50 моль и 6,40 моль соответственно. Рассчитайте массовую долю железа в сплаве.
Решение. №241 (с. 42)
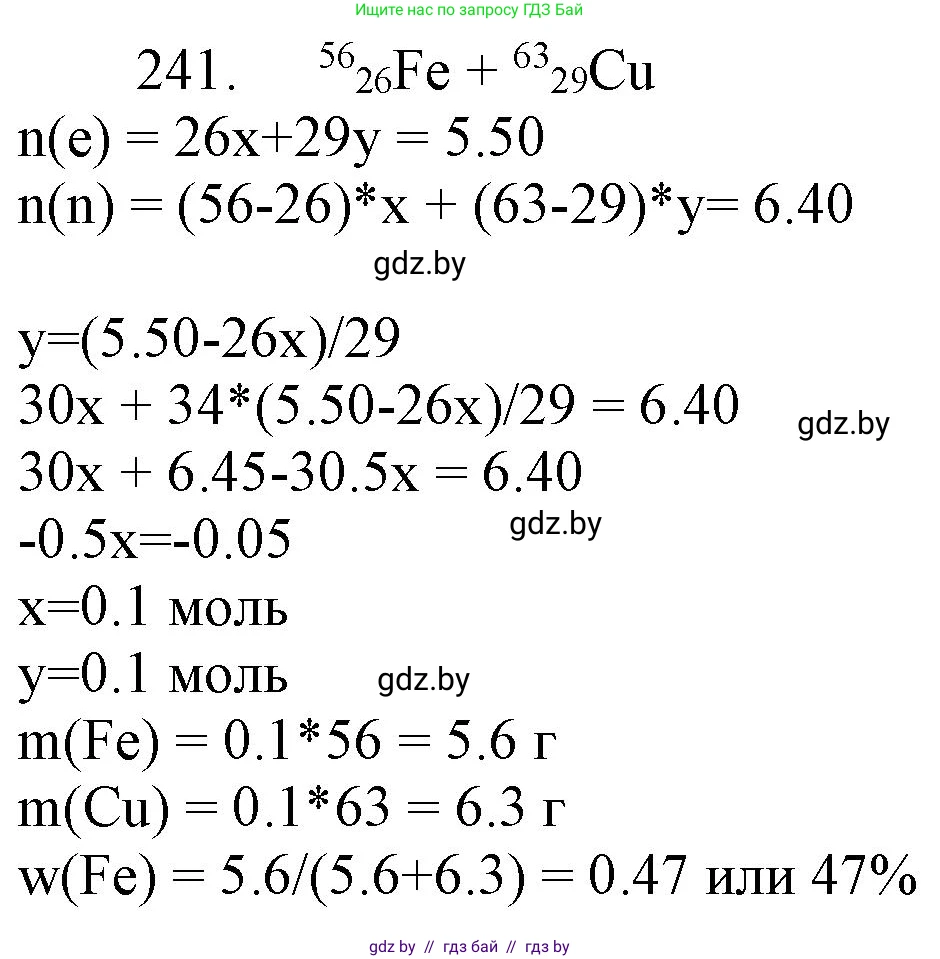
Решение 3. №241 (с. 42)
Дано:
Сплав: железо-56 ($^{56}\text{Fe}$) и медь-63 ($^{63}\text{Cu}$)
Химическое количество электронов: $n_{e} = 5,50$ моль
Химическое количество нейтронов: $n_{n} = 6,40$ моль
Найти:
Массовую долю железа в сплаве, $\omega(\text{Fe})$
Решение:
1. Определим количество электронов и нейтронов в одном нейтральном атоме каждого изотопа.
Для изотопа железа-56 ($^{56}_{26}\text{Fe}$):
Порядковый номер железа (Fe) равен 26. Следовательно, в атоме железа 26 протонов и 26 электронов. Число электронов $Z_{e, \text{Fe}} = 26$.
Массовое число изотопа равно 56. Число нейтронов равно разности массового числа и числа протонов: $N_{n, \text{Fe}} = 56 - 26 = 30$.
Для изотопа меди-63 ($^{63}_{29}\text{Cu}$):
Порядковый номер меди (Cu) равен 29. Следовательно, в атоме меди 29 протонов и 29 электронов. Число электронов $Z_{e, \text{Cu}} = 29$.
Массовое число изотопа равно 63. Число нейтронов: $N_{n, \text{Cu}} = 63 - 29 = 34$.
2. Составим систему уравнений. Пусть $n(\text{Fe})$ и $n(\text{Cu})$ – химические количества (в молях) железа и меди в сплаве соответственно.
Общее химическое количество электронов в сплаве равно сумме количеств электронов от железа и меди:
$Z_{e, \text{Fe}} \cdot n(\text{Fe}) + Z_{e, \text{Cu}} \cdot n(\text{Cu}) = n_{e, \text{общ}}$
$26 \cdot n(\text{Fe}) + 29 \cdot n(\text{Cu}) = 5,50$ (уравнение 1)
Общее химическое количество нейтронов в сплаве равно сумме количеств нейтронов от железа и меди:
$N_{n, \text{Fe}} \cdot n(\text{Fe}) + N_{n, \text{Cu}} \cdot n(\text{Cu}) = n_{n, \text{общ}}$
$30 \cdot n(\text{Fe}) + 34 \cdot n(\text{Cu}) = 6,40$ (уравнение 2)
3. Решим полученную систему уравнений:
$\begin{cases} 26 \cdot n(\text{Fe}) + 29 \cdot n(\text{Cu}) = 5,50 \\ 30 \cdot n(\text{Fe}) + 34 \cdot n(\text{Cu}) = 6,40 \end{cases}$
Для решения системы умножим первое уравнение на 30, а второе на 26:
$\begin{cases} 780 \cdot n(\text{Fe}) + 870 \cdot n(\text{Cu}) = 165 \\ 780 \cdot n(\text{Fe}) + 884 \cdot n(\text{Cu}) = 166,4 \end{cases}$
Вычтем первое уравнение из второго:
$(884 - 870) \cdot n(\text{Cu}) = 166,4 - 165$
$14 \cdot n(\text{Cu}) = 1,4$
$n(\text{Cu}) = \frac{1,4}{14} = 0,10$ моль.
Подставим найденное значение $n(\text{Cu})$ в первое исходное уравнение:
$26 \cdot n(\text{Fe}) + 29 \cdot 0,10 = 5,50$
$26 \cdot n(\text{Fe}) + 2,90 = 5,50$
$26 \cdot n(\text{Fe}) = 5,50 - 2,90$
$26 \cdot n(\text{Fe}) = 2,60$
$n(\text{Fe}) = \frac{2,60}{26} = 0,10$ моль.
4. Рассчитаем массы железа и меди в сплаве. Молярные массы изотопов с высокой точностью равны их массовым числам, выраженным в г/моль.
$M(^{56}\text{Fe}) = 56$ г/моль
$M(^{63}\text{Cu}) = 63$ г/моль
Масса железа: $m(\text{Fe}) = n(\text{Fe}) \cdot M(\text{Fe}) = 0,10 \text{ моль} \cdot 56 \text{ г/моль} = 5,6$ г.
Масса меди: $m(\text{Cu}) = n(\text{Cu}) \cdot M(\text{Cu}) = 0,10 \text{ моль} \cdot 63 \text{ г/моль} = 6,3$ г.
5. Найдем общую массу сплава:
$m_{\text{сплава}} = m(\text{Fe}) + m(\text{Cu}) = 5,6 \text{ г} + 6,3 \text{ г} = 11,9$ г.
6. Рассчитаем массовую долю ($\omega$) железа в сплаве:
$\omega(\text{Fe}) = \frac{m(\text{Fe})}{m_{\text{сплава}}} = \frac{5,6 \text{ г}}{11,9 \text{ г}} \approx 0,470588...$
Выразим в процентах и округлим результат до трех значащих цифр (в соответствии с точностью исходных данных).
$\omega(\text{Fe}) \approx 47,1\%$
Ответ: массовая доля железа в сплаве составляет 47,1%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 241 расположенного на странице 42 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №241 (с. 42), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














