Номер 334, страница 52 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 3. Химическая связь и строение вещества. Параграф 13. Природа и типы химической связи - номер 334, страница 52.
№334 (с. 52)
Условие. №334 (с. 52)
скриншот условия

334. Какие из атомов могут выступать акцепторами электронных пар: водород, калий, фтор, сера? Приведите электронно-графические схемы этих атомов и укажите на них соответствующие орбитали.
Решение. №334 (с. 52)
Решение 3. №334 (с. 52)
Акцепторами электронных пар (кислотами Льюиса) могут выступать атомы, имеющие свободные (вакантные) атомные орбитали на валентном или близком к нему по энергии подуровне. На эти орбитали атом может принять электронную пару от другого атома (донора), образуя ковалентную связь по донорно-акцепторному механизму. Рассмотрим каждый из предложенных атомов.
Водород (H)
Атом водорода имеет порядковый номер 1. Его электронная конфигурация $1s^1$.
Электронно-графическая схема валентного уровня атома водорода:
В основном состоянии атом водорода не имеет вакантных орбиталей на своем единственном (валентном) энергетическом уровне. Однако его катион — протон ($H^+$) — имеет полностью свободную 1s-орбиталь ($1s^0$) и является сильным акцептором электронной пары. Например, при образовании иона гидроксония $H_3O^+$ из молекулы воды и протона, протон принимает на свою вакантную орбиталь электронную пару от атома кислорода. Таким образом, элемент водород способен выступать в роли акцептора электронной пары.
Ответ: Атом водорода может выступать акцептором электронной пары, как правило, в виде катиона $H^+$, который имеет вакантную 1s-орбиталь.
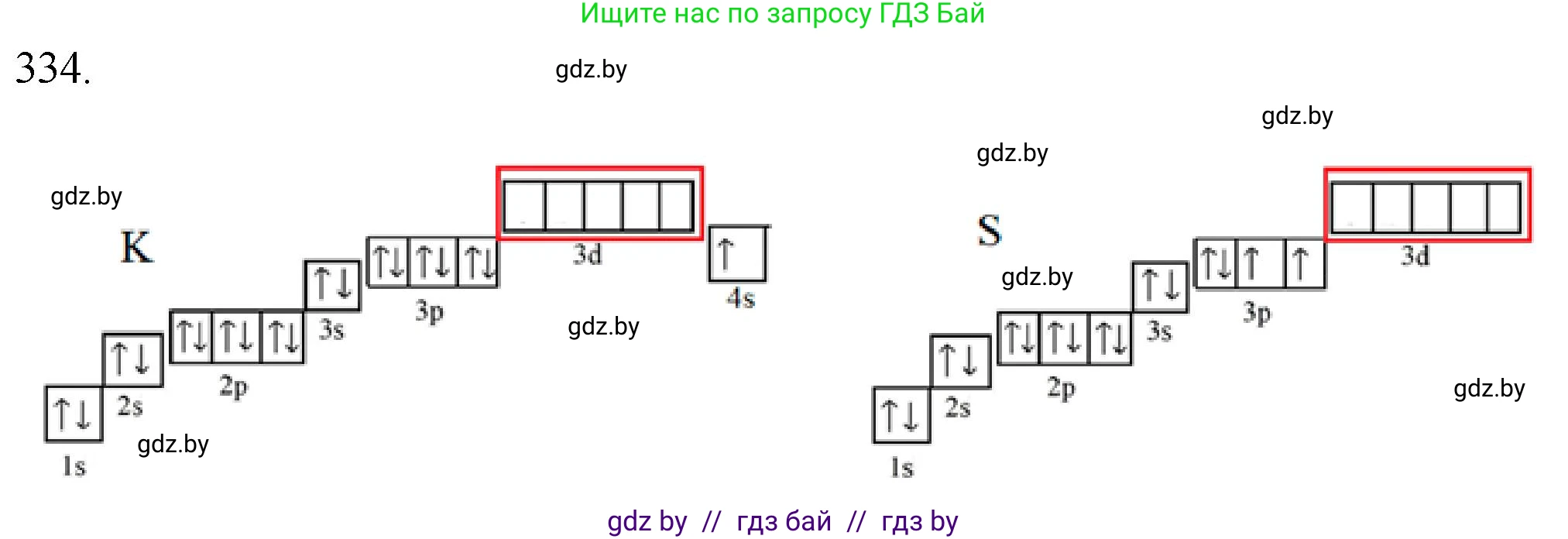
Калий (K)
Атом калия имеет порядковый номер 19. Электронная конфигурация валентного слоя: $4s^1$.
Электронно-графическая схема валентного уровня атома калия:
Калий — щелочной металл. Несмотря на наличие вакантных 4p-орбиталей на валентном уровне, он обладает очень низкой электроотрицательностью и энергией ионизации. Поэтому атом калия склонен не принимать, а отдавать свой единственный валентный электрон, выступая в роли донора электронов (восстановителя), а не акцептора электронной пары.
Ответ: Атом калия не может выступать акцептором электронной пары.
Фтор (F)
Атом фтора имеет порядковый номер 9. Электронная конфигурация валентного слоя: $2s^2 2p^5$.
Электронно-графическая схема валентного уровня атома фтора:
На валентном (втором) энергетическом уровне у атома фтора нет свободных орбиталей. d-подуровень на втором уровне отсутствует. Из-за этого фтор не может расширять свою валентную оболочку ("расширять октет") и принимать электронные пары. Напротив, являясь самым электроотрицательным элементом и имея три неподеленные электронные пары, атом фтора сам является типичным донором электронных пар.
Ответ: Атом фтора не может выступать акцептором электронной пары.
Сера (S)
Атом серы имеет порядковый номер 16. Электронная конфигурация валентного слоя: $3s^2 3p^4$.
Электронно-графическая схема валентного уровня атома серы в невозбужденном состоянии:
Атом серы является элементом 3-го периода. Его валентный уровень ($n=3$) помимо s- и p-орбиталей содержит также и d-подуровень, который в основном состоянии атома является вакантным. Эти свободные 3d-орбитали являются акцепторными. Благодаря их наличию атом серы может принимать электронные пары от доноров, образуя химические связи по донорно-акцепторному механизму и проявляя валентность выше двух. Например, в реакции $SO_3 + H_2O \rightarrow H_2SO_4$ атом серы в триоксиде серы выступает в роли акцептора электронной пары от атома кислорода молекулы воды.
Ответ: Атом серы может выступать акцептором электронной пары благодаря наличию вакантных 3d-орбиталей на валентном уровне.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 334 расположенного на странице 52 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №334 (с. 52), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














