Номер 489, страница 75 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 4. Химические реакции. Параграф 18. Классификация и общие характеристики химических реакций - номер 489, страница 75.
№489 (с. 75)
Условие. №489 (с. 75)
скриншот условия

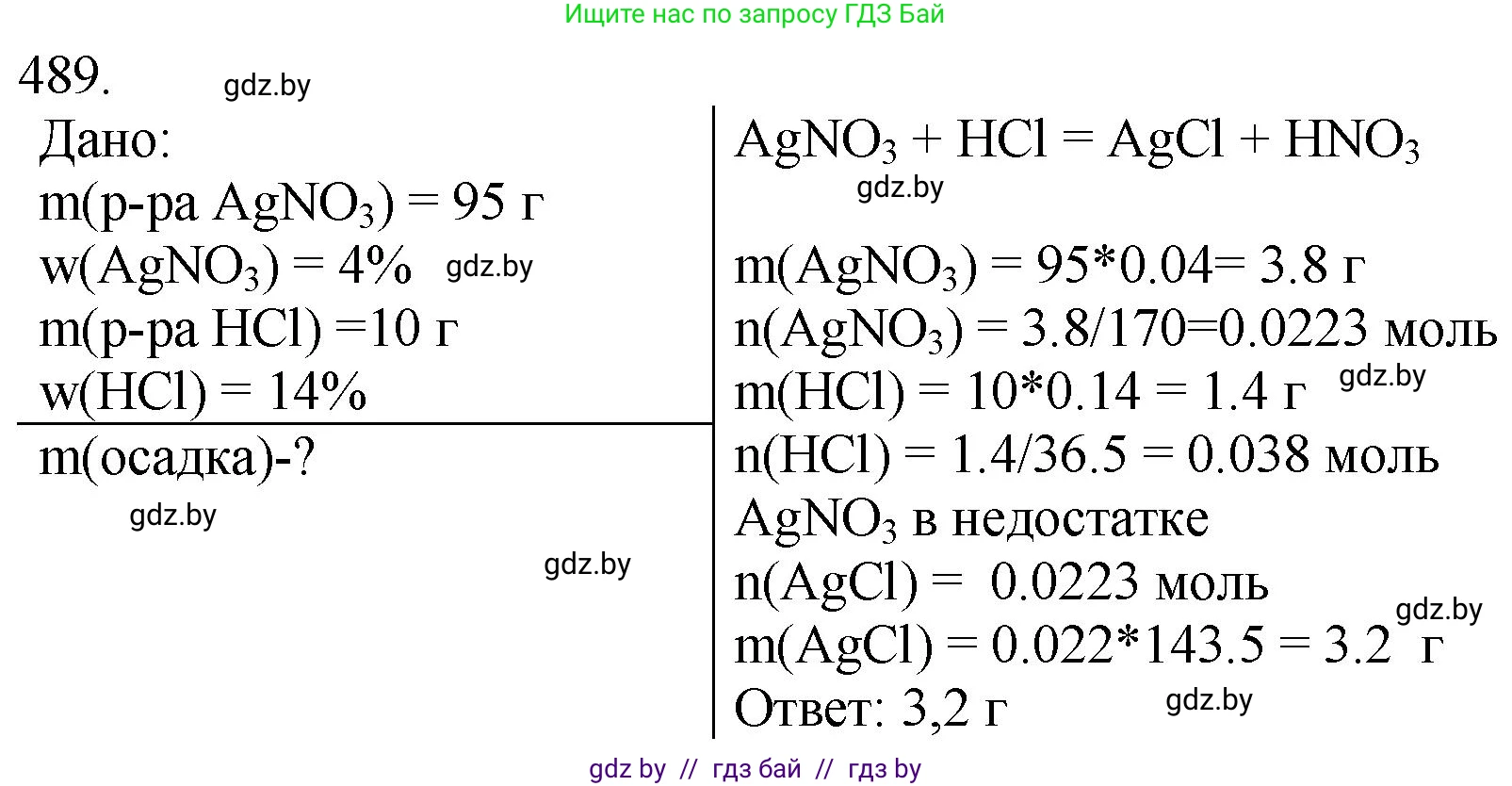
489. Осадок какой массы образуется при сливании раствора массой 95 г с массовой долей раствора нитрата серебра 4,0 % и раствора массой 10 г с массовой долей хлороводорода 14 %?
Решение. №489 (с. 75)
Решение 3. №489 (с. 75)
Дано:
$m_{р-ра}(AgNO_3) = 95 \text{ г}$
$\omega(AgNO_3) = 4,0 \% = 0,04$
$m_{р-ра}(HCl) = 10 \text{ г}$
$\omega(HCl) = 14 \% = 0,14$
Найти:
$m_{осадка}$ - ?
Решение:
1. Запишем уравнение реакции между нитратом серебра и хлороводородом (соляной кислотой). В результате реакции ионного обмена образуется нерастворимый в воде осадок хлорида серебра ($AgCl$):
$AgNO_3 + HCl \rightarrow AgCl\downarrow + HNO_3$
2. Рассчитаем массы чистых веществ (реагентов) в исходных растворах, используя формулу $m_{вещества} = m_{раствора} \times \omega_{вещества}$:
Масса нитрата серебра:
$m(AgNO_3) = 95 \text{ г} \times 0,04 = 3,8 \text{ г}$
Масса хлороводорода:
$m(HCl) = 10 \text{ г} \times 0,14 = 1,4 \text{ г}$
3. Вычислим молярные массы реагентов и количество вещества каждого из них, чтобы определить лимитирующий реагент. Расчеты будем проводить по формуле $\nu = m / M$.
Молярная масса нитрата серебра ($AgNO_3$):
$M(AgNO_3) = 108 + 14 + 3 \times 16 = 170 \text{ г/моль}$
Молярная масса хлороводорода ($HCl$):
$M(HCl) = 1 + 35,5 = 36,5 \text{ г/моль}$
Количество вещества нитрата серебра:
$\nu(AgNO_3) = \frac{3,8 \text{ г}}{170 \text{ г/моль}} \approx 0,02235 \text{ моль}$
Количество вещества хлороводорода:
$\nu(HCl) = \frac{1,4 \text{ г}}{36,5 \text{ г/моль}} \approx 0,03836 \text{ моль}$
4. Определим, какой из реагентов находится в недостатке. Согласно уравнению реакции, вещества реагируют в мольном соотношении $1:1$. Сравним количество вещества реагентов:
$0,02235 \text{ моль } (AgNO_3) < 0,03836 \text{ моль } (HCl)$
Так как нитрата серебра меньше, он является лимитирующим реагентом. Это означает, что он прореагирует полностью, и дальнейшие расчеты массы осадка следует вести по нему.
5. Рассчитаем массу образовавшегося осадка хлорида серебра ($AgCl$). Из уравнения реакции следует, что количество вещества $AgCl$ равно количеству вещества лимитирующего реагента ($AgNO_3$):
$\nu(AgCl) = \nu(AgNO_3) \approx 0,02235 \text{ моль}$
Вычислим молярную массу хлорида серебра:
$M(AgCl) = 108 + 35,5 = 143,5 \text{ г/моль}$
Теперь найдем массу осадка по формуле $m = \nu \times M$:
$m(AgCl) = 0,02235 \text{ моль} \times 143,5 \text{ г/моль} \approx 3,208 \text{ г}$
6. Округлим результат с учетом точности исходных данных. Наименее точные данные (массовые доли) имеют две значащие цифры, поэтому ответ следует округлить до двух значащих цифр.
$m(AgCl) \approx 3,2 \text{ г}$
Ответ: масса образовавшегося осадка равна 3,2 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 489 расположенного на странице 75 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №489 (с. 75), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














