Номер 493, страница 75 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 4. Химические реакции. Параграф 18. Классификация и общие характеристики химических реакций - номер 493, страница 75.
№493 (с. 75)
Условие. №493 (с. 75)
скриншот условия

493. Рассчитайте объём раствора с массовой долей серной кислоты $15,0\ \%$ и плотностью $1,10\ \text{г}/\text{см}^3$, который потребуется для полного растворения цинка массой $5,0\ \text{г}$.
Решение. №493 (с. 75)
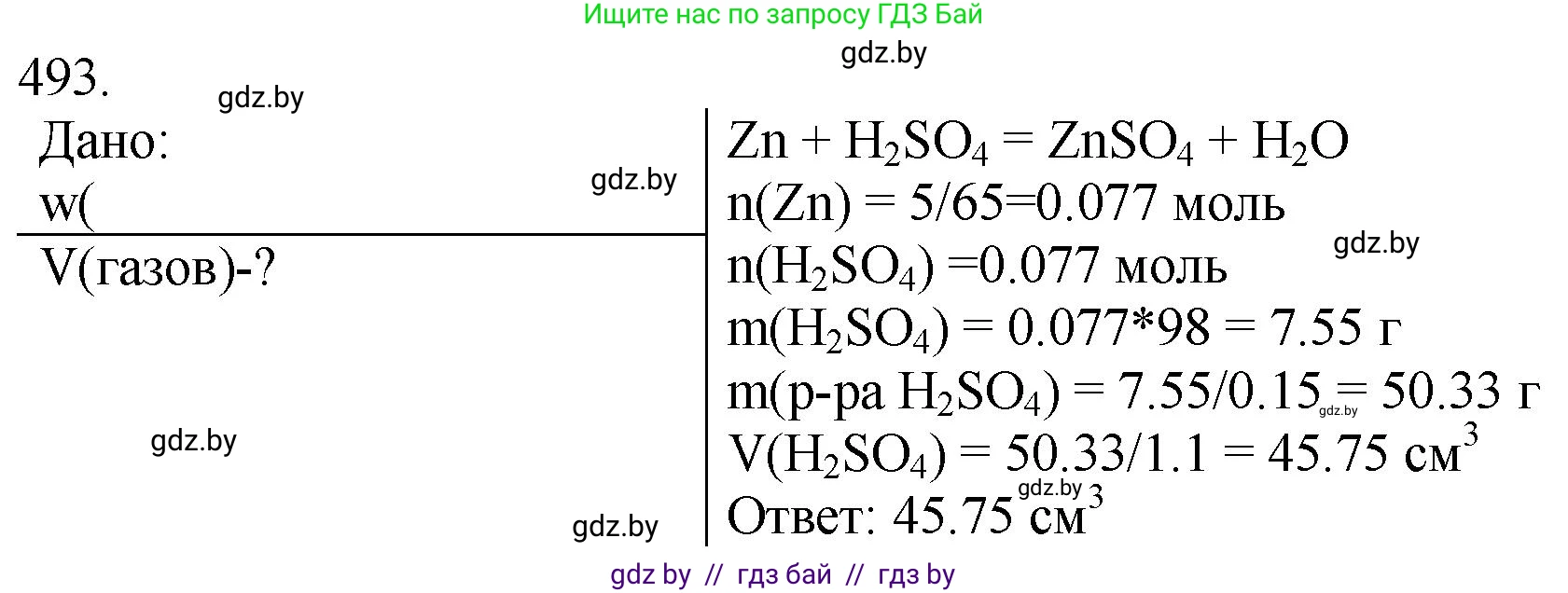
Решение 3. №493 (с. 75)
Дано:
Массовая доля серной кислоты, $w(\text{H}_2\text{SO}_4) = 15.0 \% = 0.150$
Плотность раствора, $\rho = 1.10 \text{ г/см}^3$
Масса цинка, $m(\text{Zn}) = 5.0 \text{ г}$
Перевод данных в систему СИ:
$\rho = 1.10 \frac{\text{г}}{\text{см}^3} = 1.10 \cdot \frac{10^{-3} \text{ кг}}{(10^{-2} \text{ м})^3} = 1100 \frac{\text{кг}}{\text{м}^3}$
$m(\text{Zn}) = 5.0 \text{ г} = 5.0 \times 10^{-3} \text{ кг}$
Найти:
Объем раствора серной кислоты $V(\text{р-ра H}_2\text{SO}_4)$ — ?
Решение:
1. Запишем уравнение химической реакции растворения цинка в серной кислоте: $$ \text{Zn} + \text{H}_2\text{SO}_4 \rightarrow \text{ZnSO}_4 + \text{H}_2 \uparrow $$
2. Рассчитаем молярные массы цинка ($M(\text{Zn})$) и серной кислоты ($M(\text{H}_2\text{SO}_4)$), используя округленные значения атомных масс: $Ar(\text{Zn})=65$, $Ar(\text{H})=1$, $Ar(\text{S})=32$, $Ar(\text{O})=16$. $$ M(\text{Zn}) = 65 \text{ г/моль} $$ $$ M(\text{H}_2\text{SO}_4) = 2 \cdot 1 + 32 + 4 \cdot 16 = 98 \text{ г/моль} $$
3. Выведем общую формулу для расчета объема раствора.
Количество вещества цинка: $n(\text{Zn}) = \frac{m(\text{Zn})}{M(\text{Zn})}$.
Из уравнения реакции следует, что $n(\text{H}_2\text{SO}_4) = n(\text{Zn})$.
Масса чистой серной кислоты: $m(\text{H}_2\text{SO}_4) = n(\text{H}_2\text{SO}_4) \cdot M(\text{H}_2\text{SO}_4) = \frac{m(\text{Zn})}{M(\text{Zn})} \cdot M(\text{H}_2\text{SO}_4)$.
Масса раствора серной кислоты: $m(\text{р-ра}) = \frac{m(\text{H}_2\text{SO}_4)}{w(\text{H}_2\text{SO}_4)}$.
Объем раствора серной кислоты: $V(\text{р-ра}) = \frac{m(\text{р-ра})}{\rho}$.
Объединив эти шаги, получаем единую расчетную формулу: $$ V(\text{р-ра}) = \frac{m(\text{Zn}) \cdot M(\text{H}_2\text{SO}_4)}{M(\text{Zn}) \cdot w(\text{H}_2\text{SO}_4) \cdot \rho} $$
4. Подставим числовые значения в полученную формулу. Для удобства будем использовать единицы граммы и см³, так как плотность дана именно в них. $$ V(\text{р-ра}) = \frac{5.0 \text{ г} \cdot 98 \text{ г/моль}}{65 \text{ г/моль} \cdot 0.150 \cdot 1.10 \text{ г/см}^3} $$ $$ V(\text{р-ра}) = \frac{490}{10.725} \text{ см}^3 \approx 45.6876 \text{ см}^3 $$
5. Округлим полученный результат с учетом точности исходных данных. Наименее точное значение — масса цинка ($5.0 \text{ г}$), которое имеет две значащие цифры. Поэтому конечный ответ следует округлить до двух значащих цифр. $$ V(\text{р-ра}) \approx 46 \text{ см}^3 $$
Ответ: $46 \text{ см}^3$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 493 расположенного на странице 75 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №493 (с. 75), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














