Номер 717, страница 119 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 5. Химия растворов. Параграф 27. Химические свойства кислот, оснований, солей в свете теории электролитической диссоциации - номер 717, страница 119.
№717 (с. 119)
Условие. №717 (с. 119)
скриншот условия

717. Укажите верные утверждения:
а) условиями необратимости реакции ионного обмена в водном растворе является только образование осадка и выделение газа;
б) реакции ионного обмена протекают без изменения степени окисления всех химических элементов;
в) реакции между любым сильным основанием и любой сильной кислотой в водном растворе описываются одним и тем же сокращённым ионным уравнением;
г) для некоторых реакций ионного обмена полное и сокращённое ионные уравнения совпадают;
д) взаимодействие соли и кислоты в растворе всегда приводит к новой соли и новой кислоте;
е) при электролитической диссоциации гидрокарбоната калия в водном растворе образуются катионы водорода и поэтому это вещество является кислотой;
ж) при электролитической диссоциации соли в водном растворе могут образоваться гидроксид-ионы;
з) кислотно-основные свойства кислот в водных растворах обусловлены катионами водорода.
Решение. №717 (с. 119)
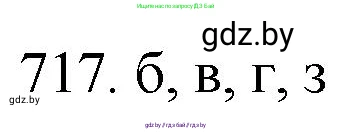
Решение 3. №717 (с. 119)
а) Утверждение неверно. Условиями необратимости (протекания до конца) реакции ионного обмена в водном растворе являются:
1. Образование осадка (малорастворимого вещества). Пример: $Ag^+ + Cl^- \rightarrow AgCl\downarrow$.
2. Выделение газа. Пример: $2H^+ + CO_3^{2-} \rightarrow H_2O + CO_2\uparrow$.
3. Образование слабого электролита, чаще всего воды. Пример: $H^+ + OH^- \rightarrow H_2O$.
Поскольку образование слабого электролита также является условием необратимости, утверждение, ограничивающееся только осадком и газом, является неполным и, следовательно, ложным.
Ответ: утверждение неверно.
б) Утверждение верно. Реакции ионного обмена характеризуются тем, что реагенты обмениваются своими ионными составляющими. В ходе таких реакций не происходит передачи или приёма электронов, поэтому степени окисления всех химических элементов, участвующих в реакции, остаются неизменными. Реакции, в которых изменяются степени окисления, называются окислительно-восстановительными.
Ответ: утверждение верно.
в) Утверждение верно. Сильные кислоты (например, $HCl$, $H_2SO_4$, $HNO_3$) и сильные основания (например, $NaOH$, $KOH$, $Ba(OH)_2$) в водном растворе практически полностью диссоциируют на ионы. Реакция между ними (реакция нейтрализации) всегда сводится к взаимодействию ионов водорода $H^+$ и гидроксид-ионов $OH^-$ с образованием молекул воды, которая является слабым электролитом.
Пример 1: $NaOH + HCl \rightarrow NaCl + H_2O$
Сокращённое ионное уравнение: $H^+ + OH^- \rightarrow H_2O$
Пример 2: $KOH + HNO_3 \rightarrow KNO_3 + H_2O$
Сокращённое ионное уравнение: $H^+ + OH^- \rightarrow H_2O$
Таким образом, суть реакции всегда одна и та же.
Ответ: утверждение верно.
г) Утверждение верно. Полное и сокращённое ионные уравнения совпадают в том случае, когда в реакции нет так называемых "ионов-наблюдателей" (spectator ions), которые присутствуют в растворе до и после реакции в неизменном виде и сокращаются при переходе от полного ионного уравнения к сокращённому. Это происходит, когда все или большинство реагентов являются слабыми электролитами, нерастворимыми веществами или газами.
Например, реакция между нерастворимым карбонатом и слабой кислотой:
$BaCO_3(тв) + 2CH_3COOH(р-р) \rightarrow Ba(CH_3COO)_2(р-р) + H_2O(ж) + CO_2(г)$
Полное ионное уравнение, учитывая, что $CH_3COOH$ — слабая кислота, а $BaCO_3$ — нерастворимое вещество, выглядит так:
$BaCO_3(тв) + 2CH_3COOH \rightarrow Ba^{2+} + 2CH_3COO^- + H_2O + CO_2\uparrow$
В левой части уравнения нет ионов, которые можно было бы сократить с ионами в правой части. Следовательно, в данном случае полное ионное уравнение совпадает с сокращённым.
Ответ: утверждение верно.
д) Утверждение неверно. Слово "всегда" делает утверждение ложным. Реакция ионного обмена между солью и кислотой протекает только в том случае, если в результате образуется осадок, газ или более слабая кислота, чем исходная. Если эти условия не выполняются, реакция не идёт.
Например, при смешивании растворов хлорида натрия и азотной кислоты реакция не происходит, так как все возможные продукты ($NaNO_3$ и $HCl$) являются сильными электролитами и хорошо растворимы в воде.
$NaCl(р-р) + HNO_3(р-р) \nrightarrow$
Ответ: утверждение неверно.
е) Утверждение неверно. Гидрокарбонат калия ($KHCO_3$) — это соль, которая в воде диссоциирует на ионы калия ($K^+$) и гидрокарбонат-ионы ($HCO_3^-$):
$KHCO_3 \rightarrow K^+ + HCO_3^-$
Диссоциация не приводит к образованию катионов водорода. Гидрокарбонат-ион является амфотерным и может вступать в равновесные реакции с водой:
1. Как кислота: $HCO_3^- \rightleftharpoons H^+ + CO_3^{2-} \quad (K_a \approx 4.7 \cdot 10^{-11})$
2. Как основание (гидролиз): $HCO_3^- + H_2O \rightleftharpoons H_2CO_3 + OH^- \quad (K_b \approx 2.2 \cdot 10^{-8})$
Поскольку константа основности ($K_b$) больше константы кислотности ($K_a$), в растворе преобладает второй процесс. В результате накапливаются гидроксид-ионы ($OH^-$), и среда становится щелочной, а не кислой.
Ответ: утверждение неверно.
ж) Утверждение верно. Образование гидроксид-ионов ($OH^-$) происходит при гидролизе солей, образованных сильным основанием и слабой кислотой. Анион слабой кислоты реагирует с водой, отщепляя от неё протон и оставляя гидроксид-ион.
Например, при диссоциации ацетата натрия ($CH_3COONa$) образуется ацетат-ион ($CH_3COO^-$), который гидролизуется:
$CH_3COO^- + H_2O \rightleftharpoons CH_3COOH + OH^-$
В результате pH раствора становится больше 7 (среда щелочная).
Ответ: утверждение верно.
з) Утверждение верно. Согласно теории электролитической диссоциации Аррениуса, кислоты — это вещества, которые при диссоциации в водных растворах образуют катионы водорода ($H^+$) в качестве единственного вида катионов. Именно наличие ионов $H^+$ (или, точнее, гидратированных ионов гидроксония $H_3O^+$) определяет общие свойства кислот: кислый вкус, изменение окраски индикаторов, взаимодействие с основаниями, активными металлами и т.д.
Ответ: утверждение верно.
Итого, верными являются утверждения: б, в, г, ж, з.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 717 расположенного на странице 119 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №717 (с. 119), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














