Номер 713, страница 119 - гдз по химии 11 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2023 - 2025
Цвет обложки: зелёный, голубой с колбами
ISBN: 978-985-599-534-1
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 11 классе
Глава 5. Химия растворов. Параграф 26. Понятие о водородном показателе (рН) раствора - номер 713, страница 119.
№713 (с. 119)
Условие. №713 (с. 119)
скриншот условия

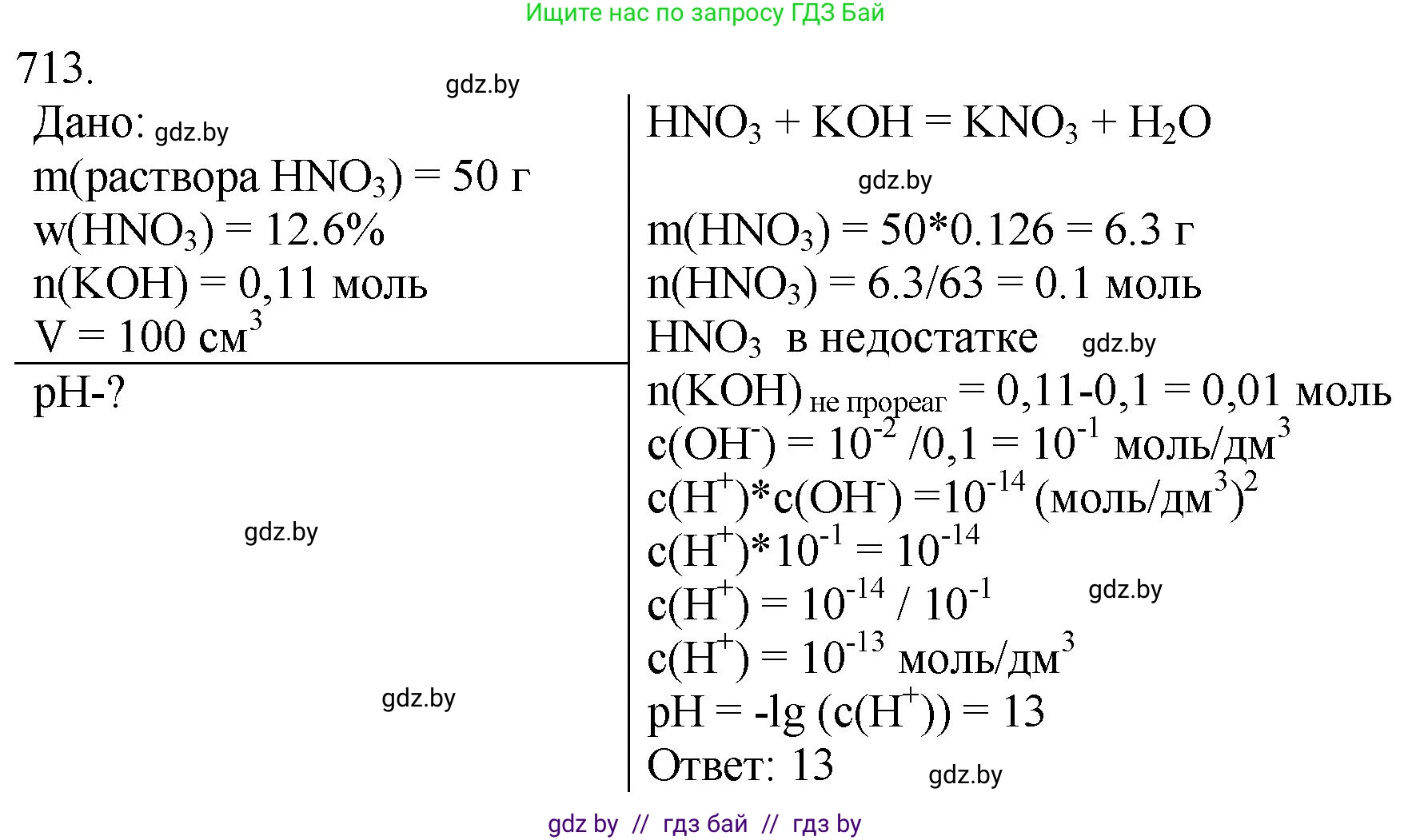
713. *К раствору массой 50 г с массовой долей азотной кислоты 12,6 % добавили раствор гидроксида калия, содержащего 0,11 моль КОН. Объём раствора довели водой до 100 см³. Рассчитайте рН приготовленного раствора.
Решение. №713 (с. 119)
Решение 3. №713 (с. 119)
Дано:
$m_{р-ра}(HNO_3) = 50 \text{ г}$
$\omega(HNO_3) = 12,6 \% = 0,126$
$n(KOH) = 0,11 \text{ моль}$
$V_{конечн. р-ра} = 100 \text{ см}^3 = 0,1 \text{ л}$
Найти:
pH - ?
Решение:
1. Запишем уравнение реакции нейтрализации между азотной кислотой и гидроксидом калия:
$HNO_3 + KOH \rightarrow KNO_3 + H_2O$
2. Рассчитаем количество вещества ($n$) азотной кислоты в исходном растворе. Сначала найдем массу чистого вещества $HNO_3$:
$m(HNO_3) = m_{р-ра}(HNO_3) \cdot \omega(HNO_3) = 50 \text{ г} \cdot 0,126 = 6,3 \text{ г}$
Молярная масса азотной кислоты $M(HNO_3)$ составляет:
$M(HNO_3) = 1 + 14 + 3 \cdot 16 = 63 \text{ г/моль}$
Теперь найдем количество вещества азотной кислоты:
$n(HNO_3) = \frac{m(HNO_3)}{M(HNO_3)} = \frac{6,3 \text{ г}}{63 \text{ г/моль}} = 0,1 \text{ моль}$
3. Сравним количества веществ реагентов, чтобы определить, какое из них находится в избытке. По условию дано $n(KOH) = 0,11 \text{ моль}$, а мы рассчитали $n(HNO_3) = 0,1 \text{ моль}$.
Согласно уравнению реакции, реагенты взаимодействуют в стехиометрическом соотношении 1:1. Поскольку $n(KOH) > n(HNO_3)$ ($0,11 \text{ моль} > 0,1 \text{ моль}$), гидроксид калия находится в избытке, а азотная кислота прореагирует полностью. Следовательно, среда в конечном растворе будет щелочной.
4. Рассчитаем количество вещества избыточного гидроксида калия, которое останется в растворе после реакции:
$n_{изб}(KOH) = n_{исх}(KOH) - n_{прореаг}(KOH)$
Количество прореагировавшего $KOH$ равно количеству $HNO_3$:
$n_{прореаг}(KOH) = n(HNO_3) = 0,1 \text{ моль}$
$n_{изб}(KOH) = 0,11 \text{ моль} - 0,1 \text{ моль} = 0,01 \text{ моль}$
5. Рассчитаем молярную концентрацию избытка гидроксида калия в конечном растворе, объем которого составляет $V_{конечн. р-ра} = 0,1 \text{ л}$:
$C(KOH) = \frac{n_{изб}(KOH)}{V_{конечн. р-ра}} = \frac{0,01 \text{ моль}}{0,1 \text{ л}} = 0,1 \text{ моль/л}$
6. Гидроксид калия является сильным основанием и в водном растворе полностью диссоциирует на ионы:
$KOH \leftrightarrow K^+ + OH^-$
Поэтому концентрация гидроксид-ионов $[OH^-]$ в растворе будет равна концентрации избытка $KOH$:
$[OH^-] = C(KOH) = 0,1 \text{ моль/л} = 10^{-1} \text{ моль/л}$
7. Рассчитаем гидроксильный показатель pOH:
$pOH = -\lg[OH^-] = -\lg(10^{-1}) = 1$
8. Зная pOH, найдем водородный показатель pH, используя соотношение $pH + pOH = 14$ (при 25 °C):
$pH = 14 - pOH = 14 - 1 = 13$
Ответ: pH приготовленного раствора равен 13.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 713 расположенного на странице 119 к сборнику задач 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №713 (с. 119), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














